ধরুন, গভীর রাতে হেঁটে বাড়ি ফিরছেন। হঠাৎ, আপনার মনে হলো পেছন থেকে কেউ আপনাকে অনুসরণ করছে। ব্যাপার বুঝতে পারার সাথে সাথে আপনি সতর্ক হয়ে উঠবেন এবং প্রতিক্রিয়ায় আপনার দেহে আসবে কিছু পরিবর্তন। যেমন, আপনার হৃৎপিণ্ডের গতি দ্রুততর হবে, মস্তিষ্কে অক্সিজেনসমৃদ্ধ রক্তের সরবরাহ বেড়ে যাবে, পাকস্থলীর রক্তপ্রবাহ কমে যাবে, যকৃত রক্তে গ্লুকোসের পরিমাণ বাড়িয়ে দেবে যাতে প্রয়োজনে ঝেড়ে দৌড় লাগাতে পারেন। আসন্ন হুমকি মোকাবেলায় দেহের এই প্রস্তুতিকে বলে ফাইট-অর-ফ্লাইট (Fight or flight) রেসপন্স। দেহে বিভিন্ন অঙ্গের এই ফাইট-অর-ফ্লাইট (Fight or flight) রেসপন্সের জন্য দায়ী একটি গ্রন্থি, নাম অ্যাড্রিনালিন (Adrenaline) গ্ল্যান্ড। অ্যাড্রিনালিন গ্ল্যান্ডের নির্গত হরমোন এপিনেফিরিন (Epinephrine) রক্তের মাধ্যমে শরীরের প্রতিটি কোষে পৌঁছে যায়। অ্যাড্রিনালিন নামের কল্যাণে ফাইট-অর-ফ্লাইট রেসপন্সকে আমরা বলি অ্যাড্রিনালিন-রাশ (Adrenaline rush)। প্রশ্ন হলো, কিভাবে রক্তে ভেসে বেড়ানো এপিনেফিরিনের অণুগুলো বিভিন্ন অঙ্গের বিভিন্ন কোষের কার্যপ্রণালীকে প্রভাবিত করে? ব্যাপারটা ব্যাখ্যার জন্য আমরা একটা নির্দিষ্ট উদাহরণ ব্যবহার করবো। আমরা দেখবো কিভাবে এপিনেফিরিন যকৃত কোষে গ্লুকোসের উৎপাদন দ্রুততর করে।
যকৃত গ্লুকোসকে গ্লাইকোজেন হিসেবে সংরক্ষণ করে। গ্লুকোসকে গ্লাইকোজেনে রূপান্তর করতে দরকার গ্লাইকোজেন-সিন্থেইস (Glycogen synthase) এনজাইমের। অন্যদিকে, গ্লাইকোজেন থেকে গ্লুকোস পেতে দরকার গ্লাইকোজেন-ফসফরেলেস (Glycogen phosphorylase) এনজাইমের। যেকোনো এনজাইমের মতোই গ্লাইকোজেন-ফসফরেলেসেরও শক্তি দরকার গ্লুকোস তৈরিতে। কোষে কিছু বিশেষ প্রোটিন এবং বিশেষ অণুর কাজ হচ্ছে এনজাইমেরদের শক্তি বিলি করে বেড়ানো। এই শক্তি বিলি হয় ফসফেট-গ্রুপ বিতরণের মাধ্যমে। ফসফেট-গ্রুপ নেগেটিভ চার্জযুক্ত, এরা এনজাইমের একটা নির্দিষ্ট অ্যামিনো-অ্যাসিডের সাথে যুক্ত হয়। ফলে ফসফেট-গ্রুপের চার্জের কারণে এনজাইমের আকারের পরিবর্তন ঘটে এবং এনজাইম সক্রিয় হয় ওঠে। অনেকটা বৈদ্যুতিক যন্ত্রের সুইচ অন করার মতো। অন্যদিকে, রাসায়নিক বিক্রিয়া ঘটানোর সময় এই ফসফেট-গ্রুপটি যখন খসে পরে তখন এনজাইম তার পূর্বের আকারে ফিরে যায় এবং নিষ্ক্রিয় হয়ে পরে। অনেকটা সুইচ অফ করার মতো। এখন, এপিনেফিরিন দুইভাবে গ্লুকোসের উৎপাদন বাড়াতে পারে, নিষ্ক্রিয় গ্লাইকোজেন-ফসফরেলেসকে সক্রিয় করার মাধ্যমে। অথবা, গ্লাইকোজেন-ফসফরেলেসের জন্য দায়ী জিন প্রকাশের (Gene expression) মাধ্যমে নতুন গ্লাইকোজেন-ফসফরেলেস তৈরি করে। জিন প্রকাশের মাধ্যমে নতুন এনজাইম সংশ্লেষণ করা একটা সময়সাপেক্ষ ব্যাপার, কিন্তু এই প্রক্রিয়াটির প্রভাব দীর্ঘমেয়াদী। অন্যদিকে, তাই নিষ্ক্রিয় এনজাইমকে সক্রিয় করা একটা দ্রুত কিন্তু স্বল্পমেয়াদী প্রক্রিয়া। জরুরী অবস্থায় কোষ উভয় প্রক্রিয়া একই সাথে চালাতে পারে।
যেকোনো হরমোনের মতোই এপিনেফিরিন একটি প্রোটিন। সমস্যা হলো, কোষের পর্দা বা মেমব্রেন (Membrane) অর্ধভেদ্য, এপিনেফিরিনসহ অধিকাংশ প্রোটিনই এই মেমব্রেন ভেদ করে কোষের ভেতরে পৌঁছুতে পারেনা। মেমব্রেনের বিষয়টি একটু বিস্তারিত বলা যাক। মেমব্রেন তৈরি হয় একধরণের কার্বোহাইড্রেট থেকে যার নাম লিপিড (Lipid)। লিপিড হলো চর্বি বা ফ্যাট (Fat)। তবে, যে বিশেষ ধরণের লিপিড মেমব্রেন তৈরি করে তাকে বলে ফসফোলিপিড (Phospholipid)।
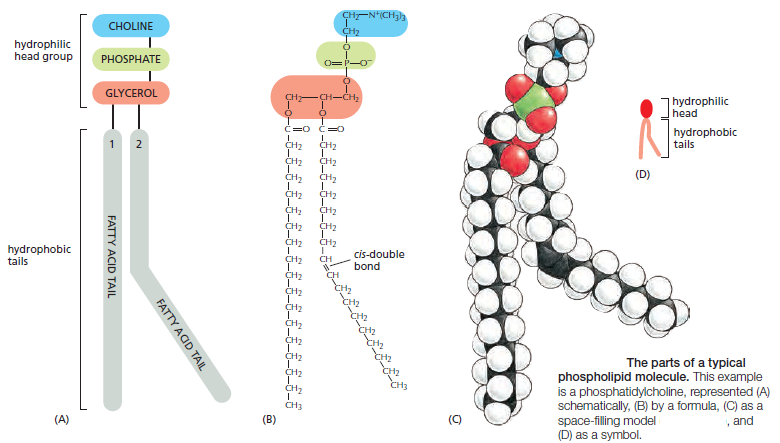
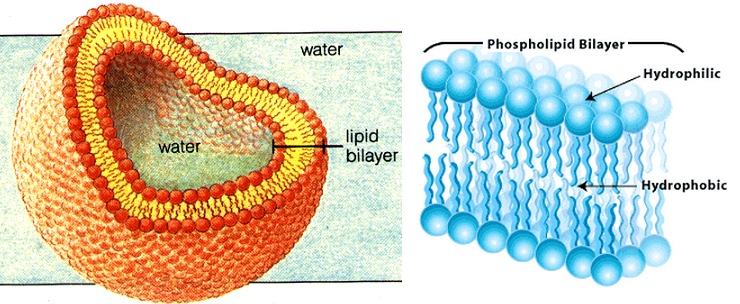
ফসফোলিপিডের দুটি অংশ আছে, ফসফেট-গ্রুপযুক্ত একটা মাথা আর কার্বন-হাইড্রোজেনের তৈরি ফ্যাটি-অ্যাসিডের লম্বা দুটি লেজ। ফসফেট-গ্রুপ নেগেটিভ চার্জযুক্ত তাই এই মাথার অংশটি হাইড্রোফিলিক। অর্থাৎ, ফসফোলিপিডের এই অংশটি পানি পছন্দ করে। অন্যদিকে, ফ্যাটি-অ্যাসিডের লম্বা লেজ দুটি চার্জ নিরপেক্ষ তাই এরা হাইড্রোফোবিক। অর্থাৎ, এরা পানি পছন্দ করে না। এই ফসফোলিপিড যখন পানির সংস্পর্শে আসে তখন এরা দুইস্তর বিশিষ্ট পর্দা তৈরি করে যাকে বলে ফসফোলিপিড বাইলেয়ার (Phospholipid bilayer)। এই ফসফোলিপিড বাইলেয়ারে হাইড্রোফোবিক লেজগুলো ভেতরে পানি থেকে দূরে এবং হাইড্রোফিলিক মাথাগুলো বাহিরের পানির কাছাকাছি থাকে।
বড় এবং চার্জযুক্ত প্রোটিন মেমব্রেনের এই হাইড্রোফোবিক অংশটি ভেদ করতে পারে না। তাই কোনো অণুকে বাহির থেকে মেমব্রেনের ভেতর কোনো প্রভাব ফেলতে সম্পূর্ণ ভিন্ন পদ্ধতি অবলম্বন করতে হয়। এই পদ্ধতিকে বলে সেলুলার-সিগন্যালিং বা আন্তঃকোষীয় সংকেত আদান-প্রদান। সেলুলার সিগন্যালিংয়ের ক্ষেত্রে কিছু প্রোটিন থাকে যারা মেমব্রেনের ফসফোলিপিড বাইলেয়ার সম্পূর্ণ ভেদ করে ফেলে। এদের এক পৃষ্ট মেমব্রেনের ভেতর সাইটোপ্লাসোমে এবং অপর পৃষ্ট মেমব্রেনের বাহিরে উন্মুক্ত অবস্থায় থাকে। এই প্রোটিনদের সাধারণভাবে মেমব্রেন-বাউন্ড-প্রোটিন (Membrane bound protein) বলে। মেমব্রেন-বাউন্ড-প্রোটিনেরা বিভিন্ন প্রকার হয়।

সেলুলার-সিগন্যালিংয়ের তিনটি ধাপ রয়েছে, রিসেপশন (Reception), ট্রান্সডাকশন (Transduction), ও রেসপন্স (Response)।

রিসেপশনে ধাপে, এপিনেফিরিন প্রথমে যুক্ত হয় যকৃত কোষের একটি বিশেষ মেমব্রেন-বাউন্ড-প্রোটিনের সাথে যার নাম জি-প্রোটিন-লিংকড-রিসেপ্টর (G protein linked receptor)। যেকোনো প্রোটিনের কাজ নির্ভর করে তার আকারের ওপর। তাই, রিসেপশনে ধাপে এপিনেফিরিনের মতো সিগন্যাল প্রোটিনগুলোর রিসেপ্টরের সাথে জোড়া লাগাও নির্ভর করে তাদের আকারের ওপর, অনেকটা জিকসো পাজেলের মতো। চাইলেই যেকোনো প্রোটিন যেকোনো রিসেপ্টরের সাথে যুক্ত হতে পারে না। তাই, কোনো সিগন্যালিং প্রোটিনের উপযুক্ত রিসেপ্টর প্রোটিন যদি কোষে না থাকে তবে কোষ ওই সিগন্যালিং প্রোটিনে কোনো সাড়াই দেবে না। যা হোক, জি-প্রোটিন-লিংকড-রিসেপ্টর প্রোটিনটি বিশাল। এর সেকেন্ডারি-স্ট্রাকচারে সাতটি আলফা-হেলিক্স কাঠামো আছে যারা মেমব্রেনের একপ্রান্ত থেকে অন্যপ্রান্ত পর্যন্ত বিস্তৃত। এই আলফা-হেলিক্সগুলো ছোট ছোট লুপের মাধ্যমে একে অন্যের সাথে লাগানো থাকে। মেমব্রেনের বাহিরে এমনই একটি লুপ হলো প্রোটিনটির সিগন্যাল-বাইন্ডিং-সাইট, যেখানে এপিনেফিরিন যুক্ত হয়। এপিনেফিরিন যুক্ত হবার ফলে, জি-প্রোটিন-লিংকড-রিসেপ্টরের আকারের পরিবর্তন ঘটে। সব রিসেপ্টর প্রোটিনই মূলত একইভাবে কাজ করে, এদের বহিঃপৃষ্টে সিগন্যালিং প্রোটিন যুক্ত হবার ফলে রিসেপ্টর প্রোটিনের অভ্যন্তরীণ পৃষ্টের আকারের পরিবর্তন ঘটে।


সাইটোপ্লাসোমের ভেতরে জি-প্রোটিন-লিংকড-রিসেপ্টরের খুব কাছাকাছি অবস্থান করে আরেকটি প্রোটিন নাম জি-প্রোটিন (G protein)। জি-প্রোটিন নিজেও মেমব্রেনের ভেতরের অংশে সাথে লেগে থাকা অপেক্ষাকৃত ছোট আকারের প্রোটিন। জি-প্রোটিন-লিংকড-রিসেপ্টরের বহিঃপৃষ্টে এপিনেফিরিন আটকানো কারণে অনেকটা স্প্রিংয়ের মতো রিসেপ্টরের অভ্যন্তরীণ পৃষ্টের আকারেরও পরিবর্তন ঘটে। ফলে, রিসেপ্টরের অভ্যন্তরীণ লুপগুলো খুব কাছে থাকা জি-প্রোটিনের সাথে আটকে যায়।


এদিকে, রিসেপ্টরের সাথে আটকে যাওয়ায় জি-প্রোটিনের আকারের পরিবর্তন ঘটে। যেটা একটা GTP-কে জি-প্রোটিনের সাথে যুক্ত হতে সাহায্য করে। তিনটি ফসফেট-গ্রুপযুক্ত GTP বা গুয়ানোসিন-ট্রাইফসফেট (Guanosine triphosphate) হলো গুয়ানিন নিউক্লিয়টাইডের বড় ভাই। GTP তার অতিরিক্ত ফসফেট-গ্রুপ ভেঙ্গে শক্তির যোগান দিতে পারে, তাই GTP যুক্ত হবার ফলে জি-প্রোটিন সক্রিয় হয় পরে। এই সক্রিয় জি-প্রোটিন রিসেপ্টর-প্রোটিন থেকে বেরিয়ে যুক্ত হয় আরেকটি বিশাল মেমব্রেন-বাউন্ড-প্রোটিনের সাথে, তবে এই প্রোটিনটি একটা এনজাইম, নাম এডেনিলিল-সাইক্লেস (Adenylyl cyclase)।

জি-প্রোটিনের সাথে জোড়া লাগায় এডেনিলিল-সাইক্লেসের আকার পরিবর্তন ঘটে এবং সে সক্রিয় হয়ে পরে। যেকোনো সক্রিয় এনজাইমের মতোই এই সক্রিয় এডেনিলিল-সাইক্লেস একটি বিশেষ জৈব রাসায়নিক বিক্রিয়া শুরু করে এবং এই বিক্রিয়ায় cAMP বা সাইক্লিক-এডেনোসিন-মনোফসফেট (Cyclic adenosine monophosphate ) নামক এক ধরণের জৈব অণু নির্গত হয়। এই cAMP-কে বলে দ্বিতীয়-বার্তাবাহক বা সেকেন্ড-ম্যাসেঞ্জার (Second messanger), প্রথম-বার্তাবাহক হলো এপিনেফিরিন। প্রথম-বার্তাবাহকে অন্য নাম লিগ্যান্ড (Ligand)। এই cAMP-ই কোষের ভেতরের সিগন্যালিং-অণু হিসেবে কাজ করে এবং কোষ এই cAMP-এর বিপরীতে প্রতিক্রিয়া সৃষ্টি করে। এপিনেফিরিনের প্রভাবে কোষের ভেতরে এই cAMP তৈরির ধাপকে বলে ট্রান্সডাকশন।

আগে বলা হয়েছিলো, এনজাইমদের সক্রিয় করতে শক্তির দরকার। এই শক্তি আসে এনজাইমের একটি নির্দিষ্ট অ্যামিনো-অ্যাসিডের সাথে একটা ফসফেটগ্রুপ জোড়া লাগার মাধ্যমে। ফসফেটগ্রুপ মাধ্যমে এই সক্রিয়করণ প্রক্রিয়াকে বলে ফসফোরেলেশন (Phosphorylation)। কোষে কিছু কিছু প্রোটিন থাকে যাদের কাজই হলো এনজাইমদের ফসফোরেলেশন প্রক্রিয়ায় সক্রিয় করা, এই প্রোটিনগুলোকে বলে প্রোটিন-কাইনেস (Protein kinase)। এই প্রোটিন-কাইনেসগুলো এতোই গুরুত্বপূর্ণ যে, ধারণা করা হয় DNA-এর প্রতি ১০০টি জিনের ১টি প্রোটিন-কাইনেস সংশ্লেষণের জন্য দায়ী। ট্রান্সডাকশন ধাপে উৎপাদিত cAMP প্রথমে প্রোটিন-কাইনেস-এ (Protein kinase A) কে সক্রিয় করে।

এরপর, এই প্রোটিন-কাইনেস-এ সক্রিয় করে আরেকটি প্রোটিন-কাইনেসকে নাম ফসফোরেলেস-কাইনেস (Phosphorylase kinase)।

সবশেষে,এই ফসফোরেলেস-কাইনেস সক্রিয় করে গ্লাইকোজেন-ফসফরেলেস এনজাইমকে। এই গ্লাইকোজেন-ফসফরেলেসই গ্লাইকোজেন ভেঙ্গে গ্লুকোস তৈরি করে। cAMP থেকে ধারাবাহিকভাবে গ্লাইকোজেন-ফসফরেলেসকে সক্রিয় করার প্রক্রিয়াকে বলে সিগন্যাল-ট্রান্সডাকশন-ক্যাসকেড (Signal transduction cascade)। এই সিগন্যাল-ট্রান্সডাকশন-ক্যাসকেড হলো রেসপন্স ধাপ।

প্রশ্ন হতে পারে, cAMP কেনো শুরুতেই গ্লাইকোজেন-ফসফরেলেসকে সক্রিয় করে না? সিগন্যাল-ট্রান্সডাকশন-ক্যাসকেড প্রক্রিয়ার কিছু কারণ নিচে দেয়া হলো,
(এক) এই ধারাবাহিক সক্রিয়করণ মূল সিগন্যালকে বহুগুণ বৃদ্ধি বা আম্প্লিফিকেশন করে। এক হিসেবে, এই প্রক্রিয়ায় মাত্র একটি এপিনেফিরিন অণু ১০০মিলিয়ন গ্লাইকোজেন-ফসফরেলেসকে সক্রিয় করতে পারে।
(দুই) সিগন্যাল-ট্রান্সডাকশন-ক্যাসকেডের বিভিন্ন ধাপগুলো ভিন্ন ভিন্ন প্রতিক্রিয়া বা রেসপন্স তৈরি করে থাকে। যেমন, উৎপাদিত গ্লুকোস যাতে সাথেসাথে আবার গ্লাইকোজেনে পরিণত না হয়, সেজন্য কিছু ধাপ গ্লাইকোজেন-সিন্থেইসকে সময়িকভাবে নিক্রিয় করে।
(তিন) কোষে বিভিন্ন সিগন্যালিং পদ্ধতিগুলোকে গুটিকয়েক শ্রেণীতে ভাগ করা যায়। জি-প্রোটিন-লিংকড-রিসেপ্টর পদ্ধতি ছাড়াও উল্লেখ করার মতো আরো কিছু পদ্ধতি হলো, টাইরোসিন-কাইনেস-রিসেপ্টর (Tyrosine kinase receptor), আয়ন-চ্যানেল-রিসেপ্টর (Ion channel রিসেপ্টর) ইত্যাদি। কোষ এই বিভিন্ন সিগন্যালিং পদ্ধতি গুলো একে অন্যের সাথে সমন্বয় করে একটা সিগন্যালিং নেটওয়ার্কের মাধ্যমে। এই নেটওয়ার্কের গড়ে ওঠে বিভিন্ন সিগন্যালিং পদ্ধতিগুলোর সিগন্যাল-ট্রান্সডাকশন-ক্যাসকেডের ভিন্ন ভিন্ন ধাপগুলোর সংযুক্তির মাধ্যমে। যেমন, কোষে যদি ইতিমধ্যে যথেষ্ট গ্লুকোস থাকে, তবে, এপিনেফিরিন থাকা সত্ত্বেও অন্যান্য সিগন্যালিংয়ের প্রভাবে গ্লাইকোজেন-ফসফরেলেস সক্রিয় নাও হতে পারে।
নতুন এনজাইম উৎপাদনের ক্ষেত্রে সিগন্যাল-ট্রান্সডাকশন-ক্যাসকেড ধাপটি উপযুক্ত ট্রান্সক্রিপশন-ফেক্টরকে সক্রিয় করে। এই ট্রান্সক্রিপশন-ফেক্টরগুলো জিনের প্রমোটর অঞ্চলে যুক্ত হয় ফলে, RNA-পলিমারেস mRNA তৈরি শুরু করে এবং প্রোটিন সংশ্লেষণ শুরু হয়।
একই সিগন্যালিং-প্রোটিন কোষ ভেদে ভিন্ন ভিন্ন প্রতিক্রিয়া সৃষ্টি করতে পারে। যেমন, এপিনেফিরিন যকৃত কোষে গ্লুকোস উৎপাদন দ্রুততর করে। অন্যদিকে, হৃৎপিণ্ডের স্পন্দন দ্রুততর করে। কিন্তু, প্রতিটি ক্ষেত্রেই কোনো না কোনো ধরণের রিসেপশন, ট্রান্সডাকশন, ও রেসপন্স ধাপগুলো অনুসরণ করা হয়।
এককোষীয় থেকে বহুকোষীয় যেকোনো ধরণের প্রাণে জন্য এই সেলুলার-সিগন্যালিং অত্যন্ত গুরত্বপূর্ণ। ভ্রুণের বিকাশে সেলুলার-সিগন্যালিংয়ের মাধ্যমের কোষেরা নিজেদের বিভাজনের হার, চলন, অবস্থান, কাজের ধরণ (Cellular differentiation) ইত্যাদি নির্ধারিত হয়। অন্যদিকে, এককোষীরা একই পদ্ধতিতে তাদের বাহ্যিক পরিবেশ সম্পর্কে জানতে পারে।
অবলম্বনে: “The Great Courses” থেকে প্রকাশিত “Biology: The Science of Life” by “Stephen Nowicki”