প্রাণীর দেহকোষ যতো কাজ করে তার প্রতিটিতেই প্রোটিনের কোনো না কোনো অবদান থাকে। প্রোটিনের এই কাজগুলো মোটামুটি পাঁচ ধরণের: যান্ত্রিক, পরিবহন, সংকেত আদান-প্রদান, নিয়ন্ত্রক, এবং অনুঘটক। যে সমস্ত প্রোটিন অনুঘটকের কাজ করে তাদের আমরা বলি উৎসেচক বা এনজাইম। প্রোটিনেরা যেভাবে কাজগুলো সম্পাদন করে সেটা তাদের জটিল ত্রিমাত্রিক আকারের ওপর নির্ভর করে। অনেকটা তালা-চাবির মতো, প্রতিটি তালা খোলার জন্য যেমন আলাদা আলাদা চাবি দরকার এবং এই চাবিগুলোর যেমন ভিন্ন ভিন্ন আকার হয়ে থাকে তেমনি, কোষে প্রত্যেকটি আলাদা আলাদা কাজের জন্য আলাদা আলাদা প্রোটিন দরকার এবং এই প্রোটিনগুলো আকারও ভিন্ন ভিন্ন হয়। সাধারণ অর্থে প্রোটিন একটা পলিমার। এই পলিমারটি অ্যামিনো-অ্যাসিড নামক একাধিক মনোমার দিয়ে তৈরি। প্রোটিনের আকার নির্ভর করে দুটি জিনিসের ওপর, অ্যামিনো-অ্যাসিডের সংখ্যা ও তাদের ক্রমবিন্যাস (Sequence)।
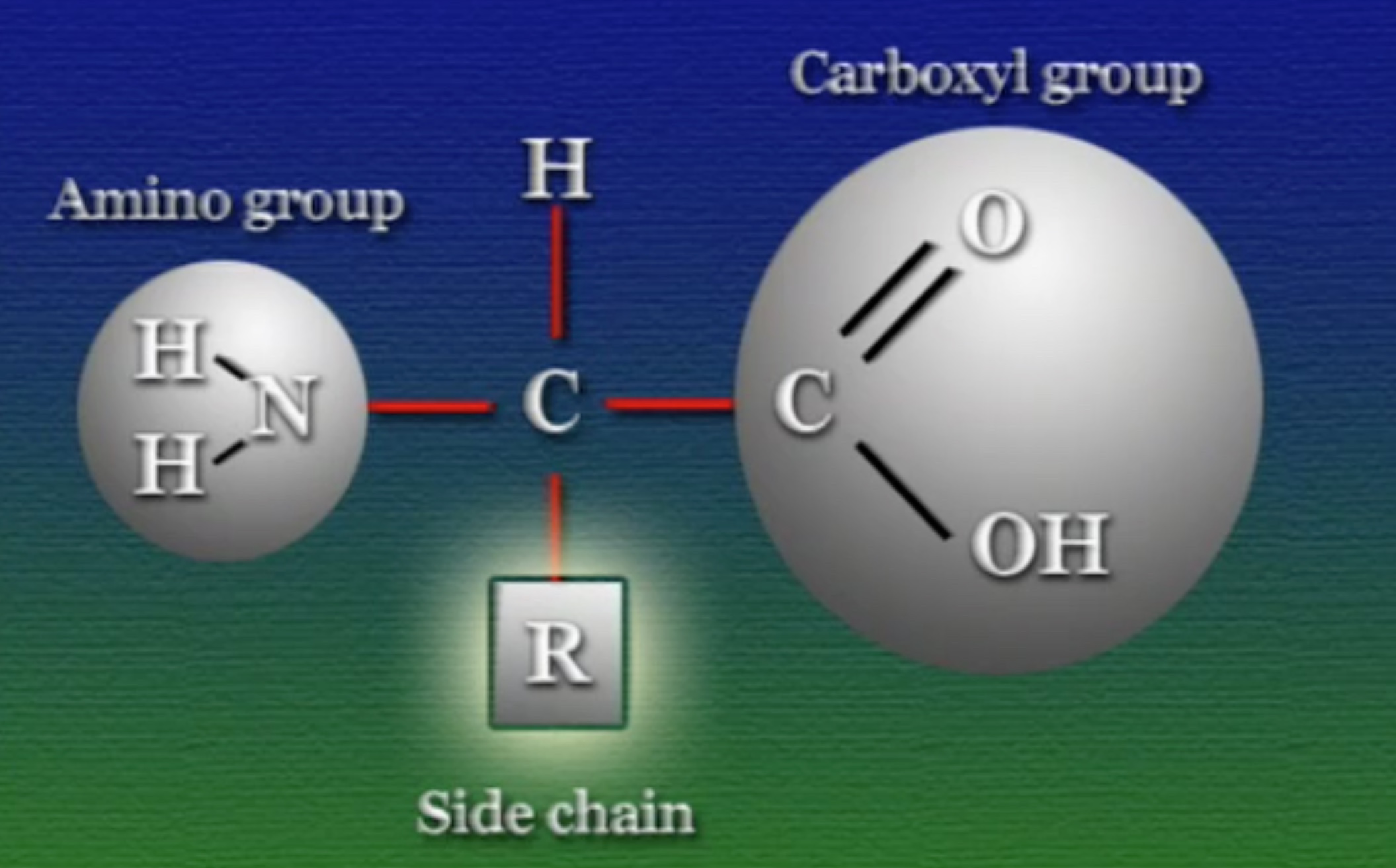
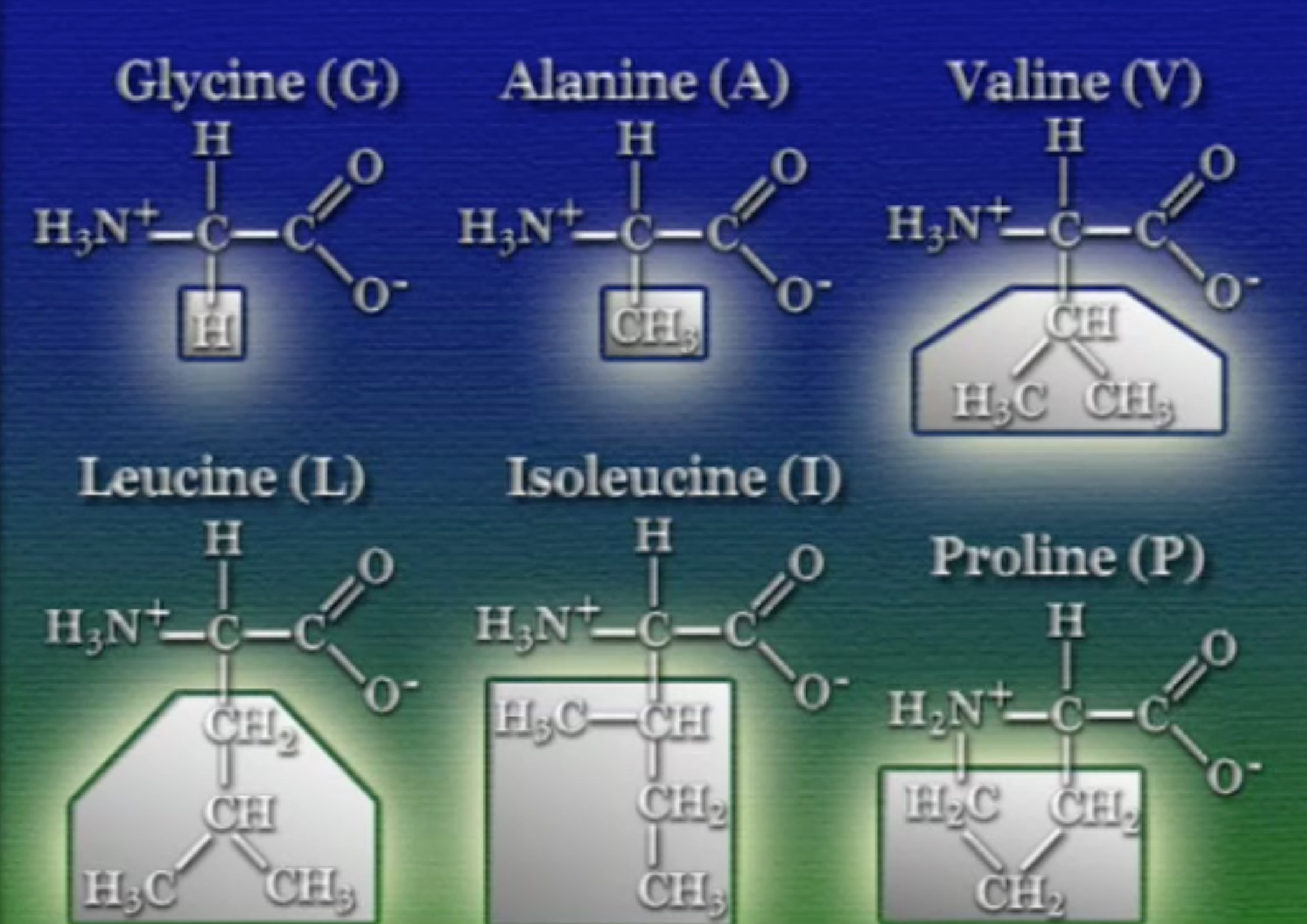
প্রকৃতিতে মোট ২০টি অ্যামিনো-অ্যাসিড পাওয়া যায়। মজার বিষয় হলো, এদের প্রতিটির গঠন মূলত একই রকম। প্রতিটি অ্যামিনো-অ্যাসিডের কেন্দ্রে একটা কার্বন থাকে। কার্বনের এক প্রান্তে থাকে একটা কার্বক্সিল-গ্রুপ। কার্বক্সিল-গ্রুপ হলো কার্বন (C), অক্সিজেন (O), ও হাইড্রোক্সিল-গ্রুপ (OH) দিয়ে তৈরি একটি যৌগ। এই কার্বক্সিল-গ্রুপের ঠিক উল্টো প্রান্তে থাকে একটা অ্যামিনো-গ্রুপ। অ্যামিনো-গ্রুপ হলো নাইট্রোজেন (N) ও হাইড্রোজেন (H) গঠিত যৌগ। তৃতীয় প্রান্তে একটা নিঃসঙ্গ হাইড্রোজেন। আর, চতুর্থ প্রান্তকে বলে সাইড-চেইন (Side Chain), একে নির্দেশ করা হয় R দিয়ে। ভিন্ন ভিন্ন অ্যামিনো-অ্যাসিডের ক্ষেত্রে এই সাইড-চেইন ভিন্ন ভিন্ন হয়। অর্থাৎ, এই সাইড-চেইনই অ্যামিনো-অ্যাসিডের আসল পরিচয়।
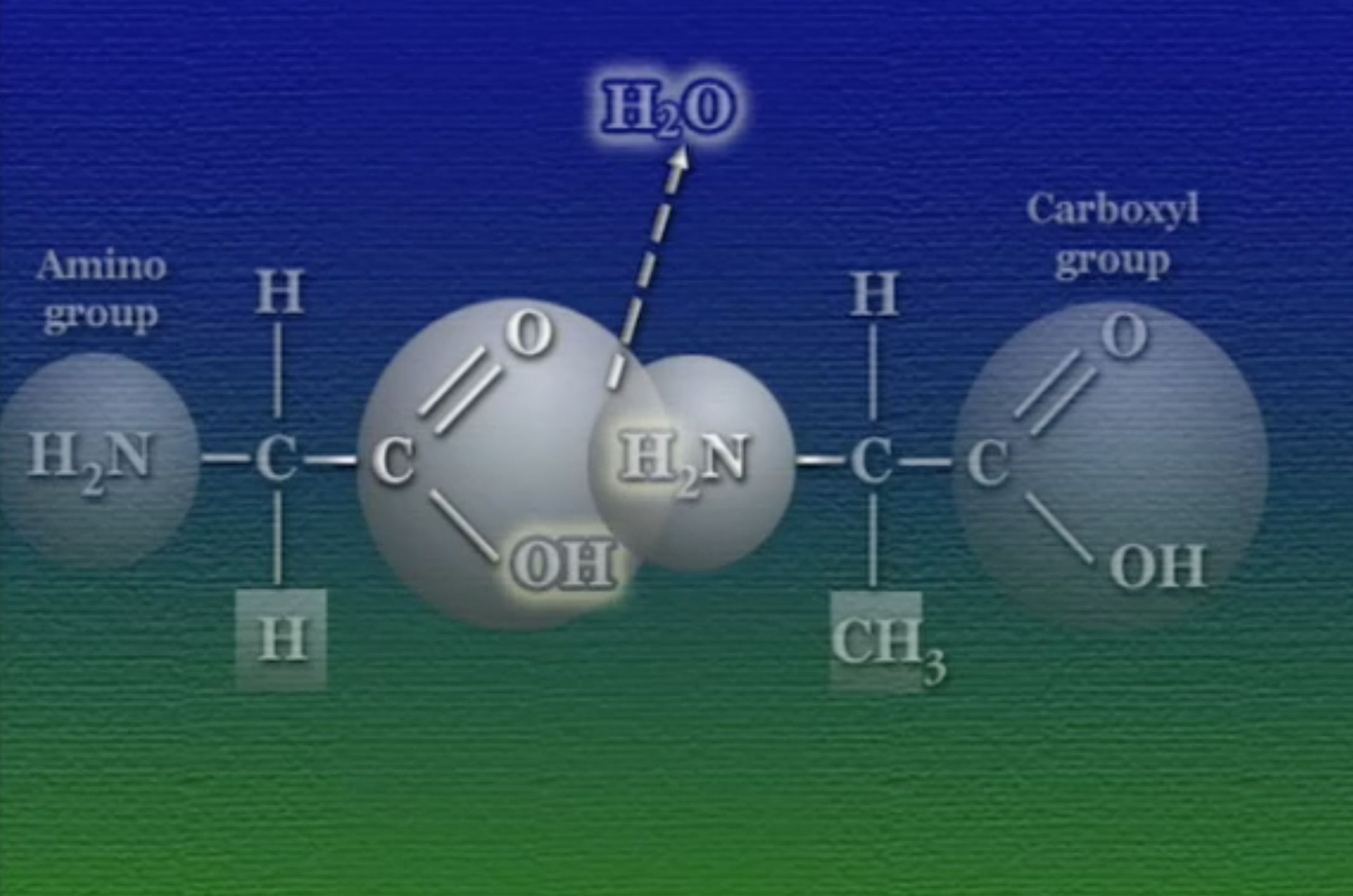
প্রোটিন গঠনের সময় পাশাপাশি অ্যামিনো-অ্যাসিডগুলো যখন জোড়া লাগে, তখন এক অ্যামিনো-অ্যাসিডের কার্বক্সিল-গ্রুপ অন্যজনের অ্যামিনো-গ্রুপের সাথে বিক্রিয়া একটা কোভেলেন্ট বন্ধন (Covelent Bond) তৈরি করে। এই বিক্রিয়ায় একটি পানির অণু বেরিয়ে যায়। কার্বক্সিল ও অ্যামিনো গ্রুপের এই কোভেলেন্ট বন্ধনকে বলে পেপটাইড (Peptide) বন্ধন। প্রায় ৫০টি থেকে ৫০০০টি অ্যামিনো-অ্যাসিড এরকম পেপটাইড গঠিন করতে পারে। ঠিক এজন্যই প্রোটিনদের বলে পলি-পেপটাইড চেইন (Polypeptide Chain) ।
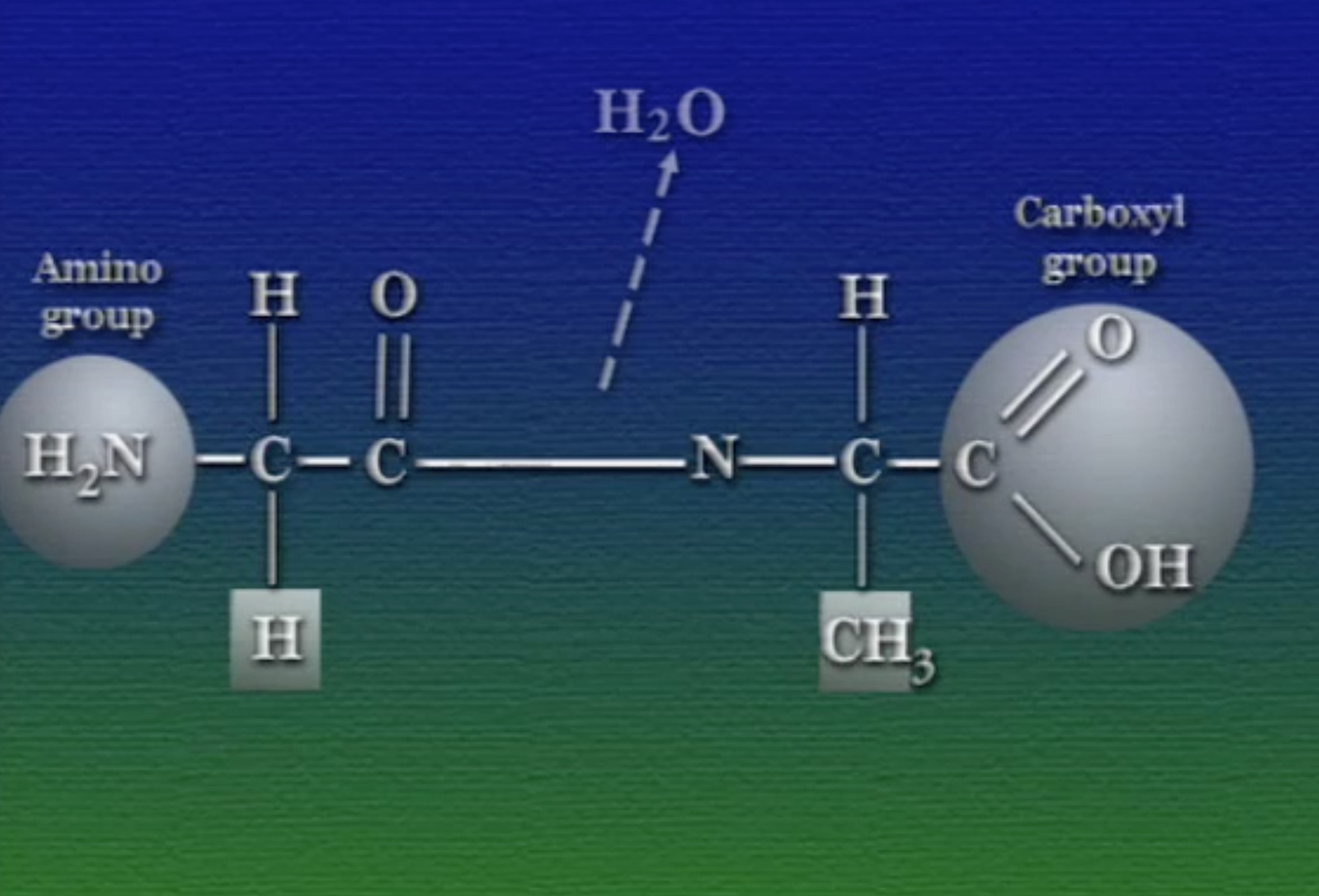
খেয়াল করলে দেখা যাবে, দুটো অ্যামিনো-অ্যাসিড জোড়া লাগার পর তারা একটা নাইট্রোজেন-কার্বন ব্যাকবোন (Backbone) গঠন করে। এই নাইট্রোজেন-কার্বন ব্যাকবোনের একপাশে থাকে নাইট্রোজেনযুক্ত অ্যামিনো-গ্রুপ ও অন্যপাশে কার্বনযুক্ত কার্বক্সিল-গ্রুপ, এদের মাঝে নাইট্রোজেন ও কার্বন পরমাণুর নিয়মিত বিন্যাস দেখা যায়। পলি-পেপটাইড চেইনের শেষপ্রান্তের এই নাইট্রোজেন ও কার্বনগুলো প্রোটিনের মেরু (Polarization) নির্ধারণ করে।
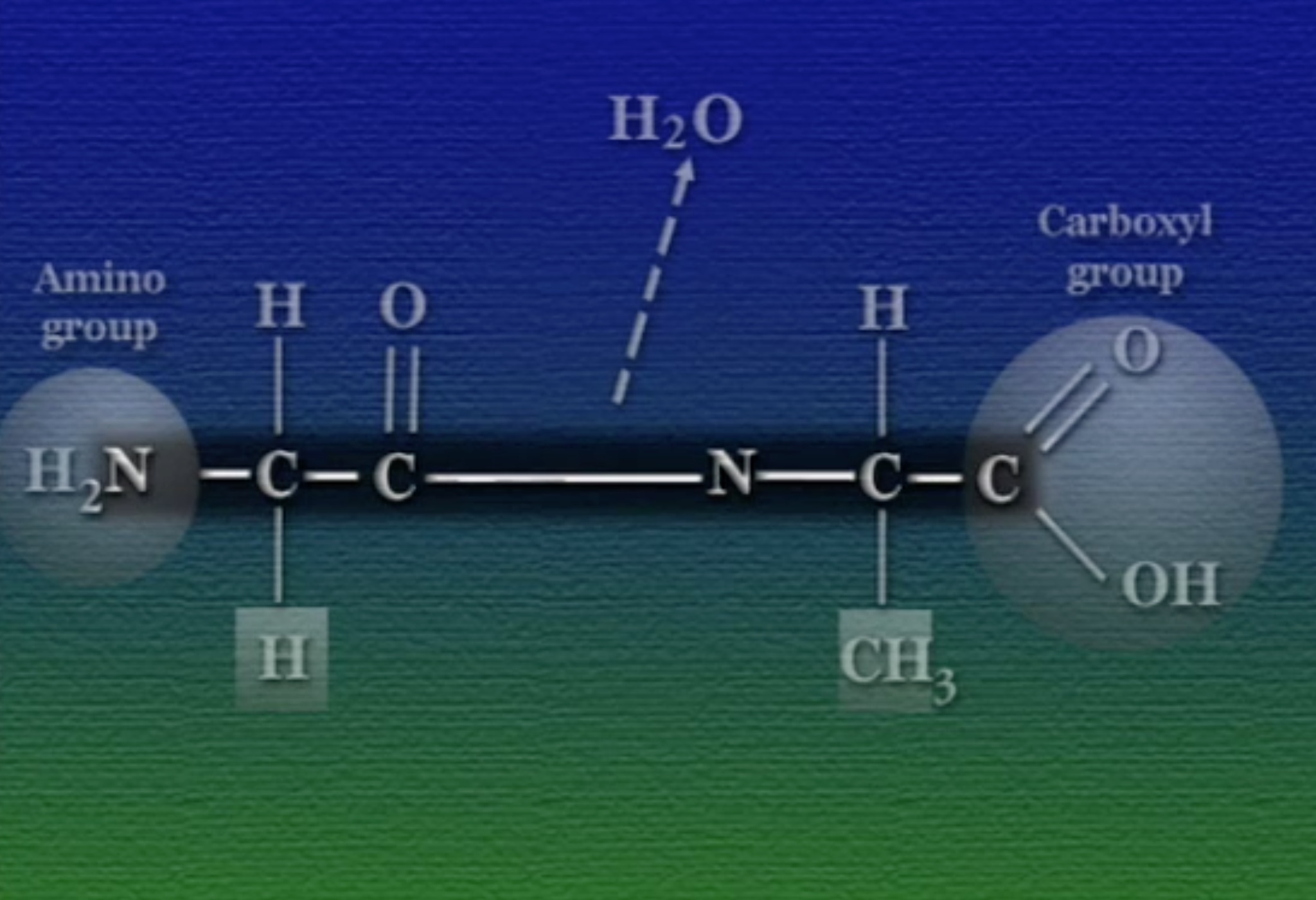
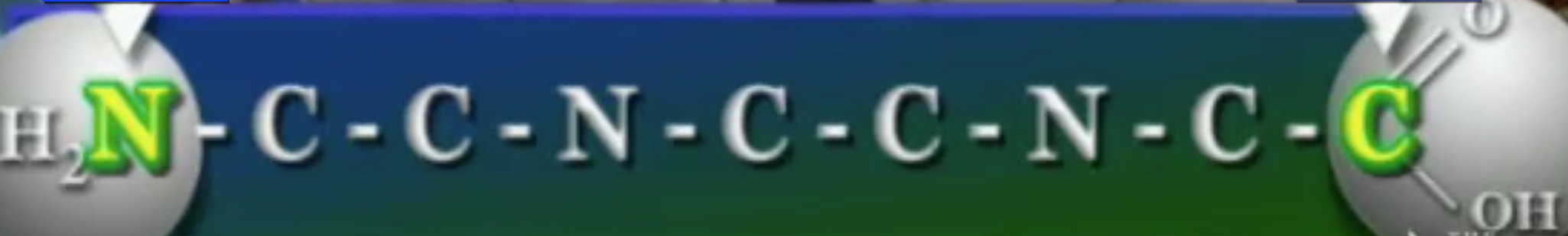
এবার আসা যাক প্রোটিনের আকারের ওপর। প্রোটিনের আকার নির্ভর করে তার পলি-পেপটাইড কাঠামোর ওপর। পলি-পেপটাইডের চারটি কাঠামো আছে।
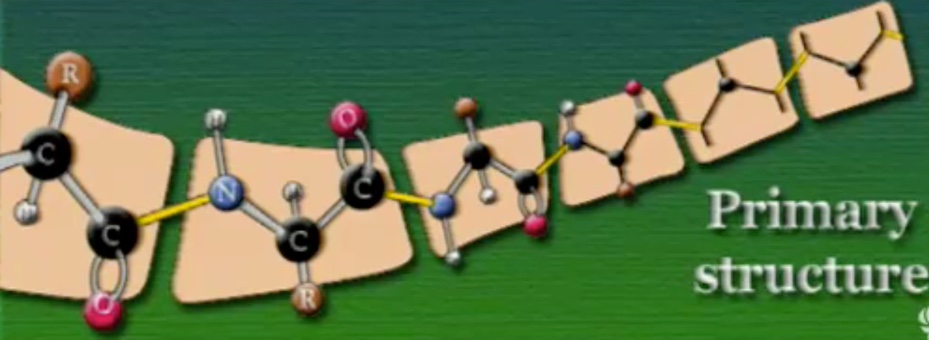
প্রাইমারি স্ট্রাকচার (Primary Structure): এই কাঠামো মূলত অ্যামিনো-অ্যাসিডগুলোর ক্রমবিন্যাস বোঝায়। অ্যামিনো-অ্যাসিডের এই ক্রমবিন্যাস পুরোপুরি নির্ভর করে DNA-এর ওপর।
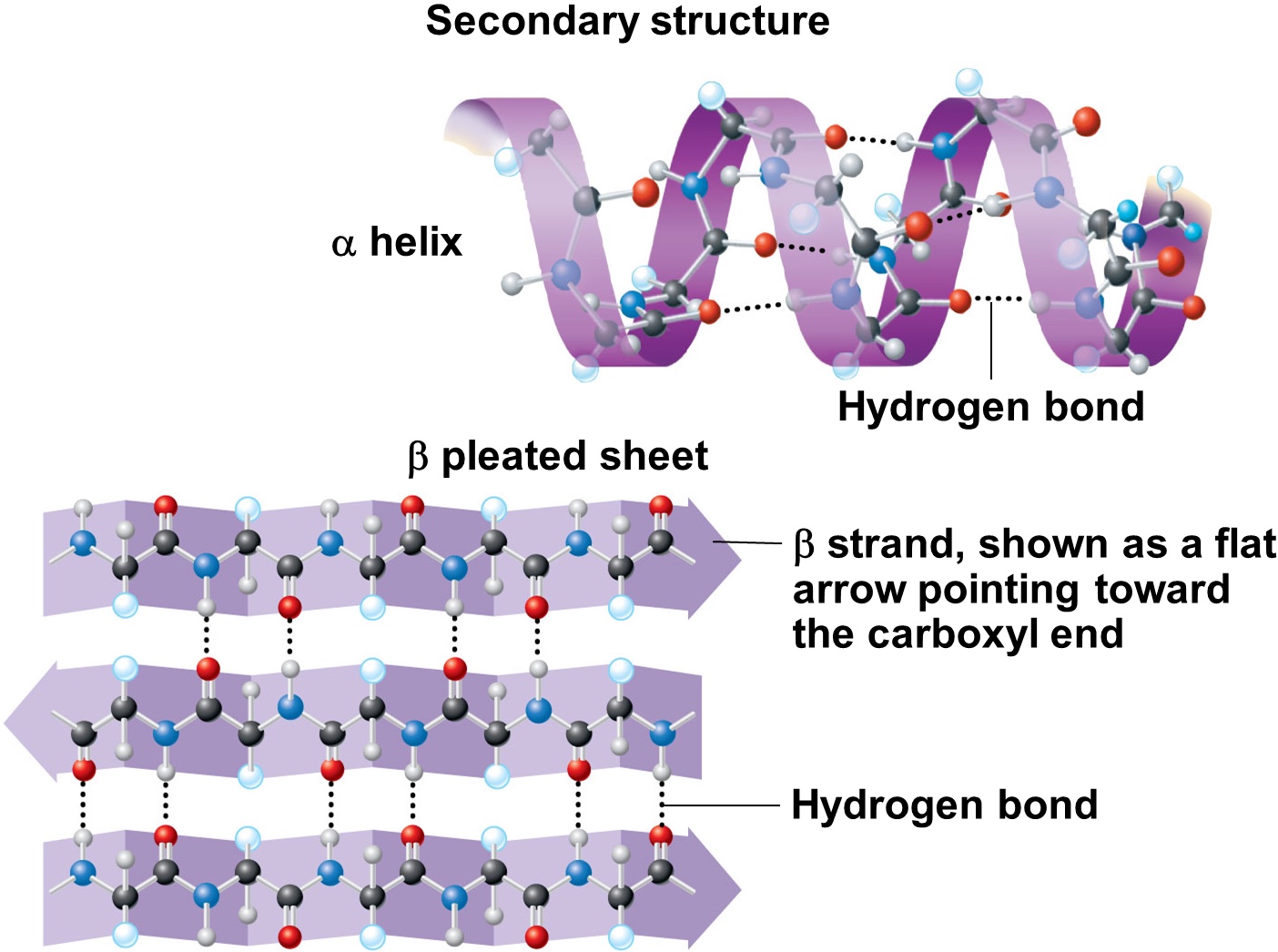
সেকেন্ডারি স্ট্রাকচার (Secondary Structure): নাইট্রোজেন-কার্বন ব্যাকবোনে পাশাপাশি নাইট্রোজেন ও কার্বনগুলো একে অন্যের সাথে দুর্বল হাইড্রোজেন বন্ধনে আবদ্ধ হয়। ফলে লম্বা দড়ির মতো পলি-পেপটাইড চেইন কখনো কখনো স্প্রিং-এর মতো পেঁচানো (আলফা হেলিক্স) আবার কখনো ভাঁজ করা কাগজের মতো (বেটা প্লেটেড শীট) আকার পায়।
টারশিয়ারী স্ট্রাকচার (Tertiary Structure): এটা পলি-পেপটাইডের সবচেয়ে গুরুত্বপূর্ণ কাঠামো। এটাই মূলত প্রোটিনকে তার কার্যক্ষম আকার দেয়। এই কাঠামো নির্ভর করে অ্যামিনো-অ্যাসিডের সাইড-চেইনের ওপর। কিছু কিছু সাইড-চেইন পানি পছন্দ করে (হাইড্রোফিলিক) আর কিছু কিছু একদমই পানি পছন্দ করে না (হাইড্রোফোবিক)। পলি-পেপটাইড গঠনের পরপর এই সাইড-চেইনগুলো যখন কোষের অভ্যন্তরীণ জলীয় অংশের সংস্পর্শে আসে তখন পুরো পলি-পেপটাইড চেইনটি গুটিয়ে যেতে শুরু করে। হাইড্রোফোবিক অ্যামিনো-অ্যাসিডগুলো ভেতর দিকে পানি থেকে দূরে আর হাইড্রোফিলিক অ্যামিনো-অ্যাসিডগুলো বাহির দিকে পানির কাছাকাছি অবস্থান করে। চেইনটি একবার গুটিয়ে গেলে বিভিন্ন অ্যামিনো-অ্যাসিডের সাইড-চেইনগুলো একে ওপরের কাছাকাছি চলে আসে, ফলে তাদের মধ্যে কেউ কেউ হাইড্রোজেন-বন্ধন আবার কেউ কেউ কোভেলেন্ট-বন্ধন বাঁধিয়ে ফেলে। এই বন্ধনগুলো টারশিয়ারী স্ট্রাকচারকে স্থিতিশীল করে।
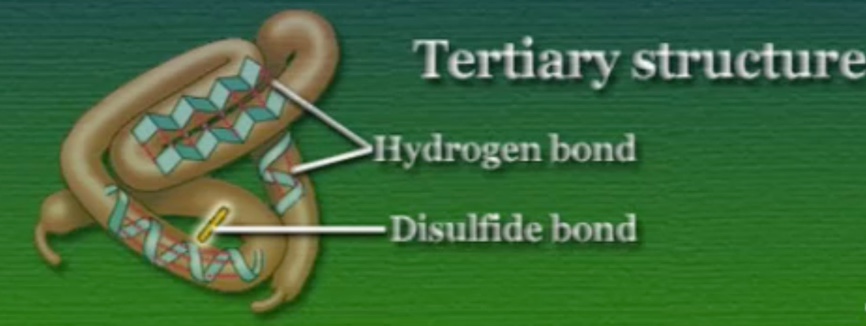
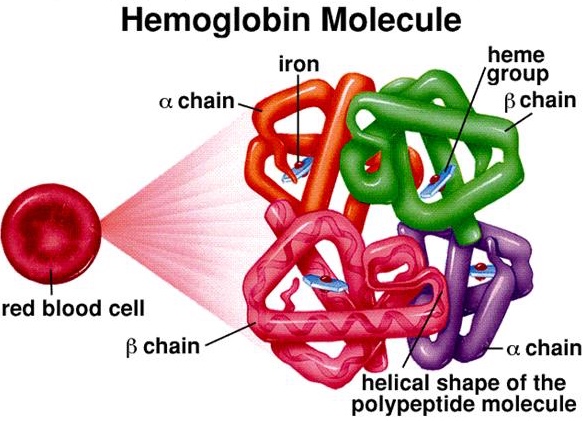
কোয়ার্টারনারি স্ট্রাকচার (Quaternary Structure): একাধিক পলি-পেপটাইড চেইন নিজেদের জড়িয়ে এই কাঠামো তৈরি করে। একটা উদাহরণ হলো, হিমোগ্লোবিন। হিমোগ্লোবিন দুটি আলফা ও দুটি বেটা পলি-পেপটাইড চেইন পরস্পরকে পেঁচিয়ে কোয়ার্টারনারি স্ট্রাকচার তৈরি করে।
একসময় এই প্রোটিনকে বংশগতির ধারক (Inherited Material) মনে করা হতো। মজার ব্যাপার হলো, তখন কিন্তু বংশগতির ক্রোমোসোম-তত্ত্ব জানা ছিলো। ক্রোমোসোমকে পরিমাপ দেখা যায় ক্রোমোসোম নিজেই মূলত প্রোটিন দিয়ে তৈরি। ক্রোমোসোমে প্রোটিন পরিমাণে DNA-এর চেয়ে ৫ থেকে ১০গুণ বেশি। এ থেকেই “প্রোটিন বংশগতির ধারক” ধারণাটি চলে এসেছিলো। ১৯৫০ সালে শুরুতে মার্থা চেজ (Martha Chase) ও আলফ্রেড হার্সে (Alfred Hershey) ব্যাকটেরিয়াফাজ ভাইরাসের ওপর পরীক্ষা চালিয়ে বংশগতির ধারক হিসেবে নিউক্লিইক-অ্যাসিড (Nucleic Acid) ভিত্তিক পলিমারকে সুচিহ্নিত করেন।
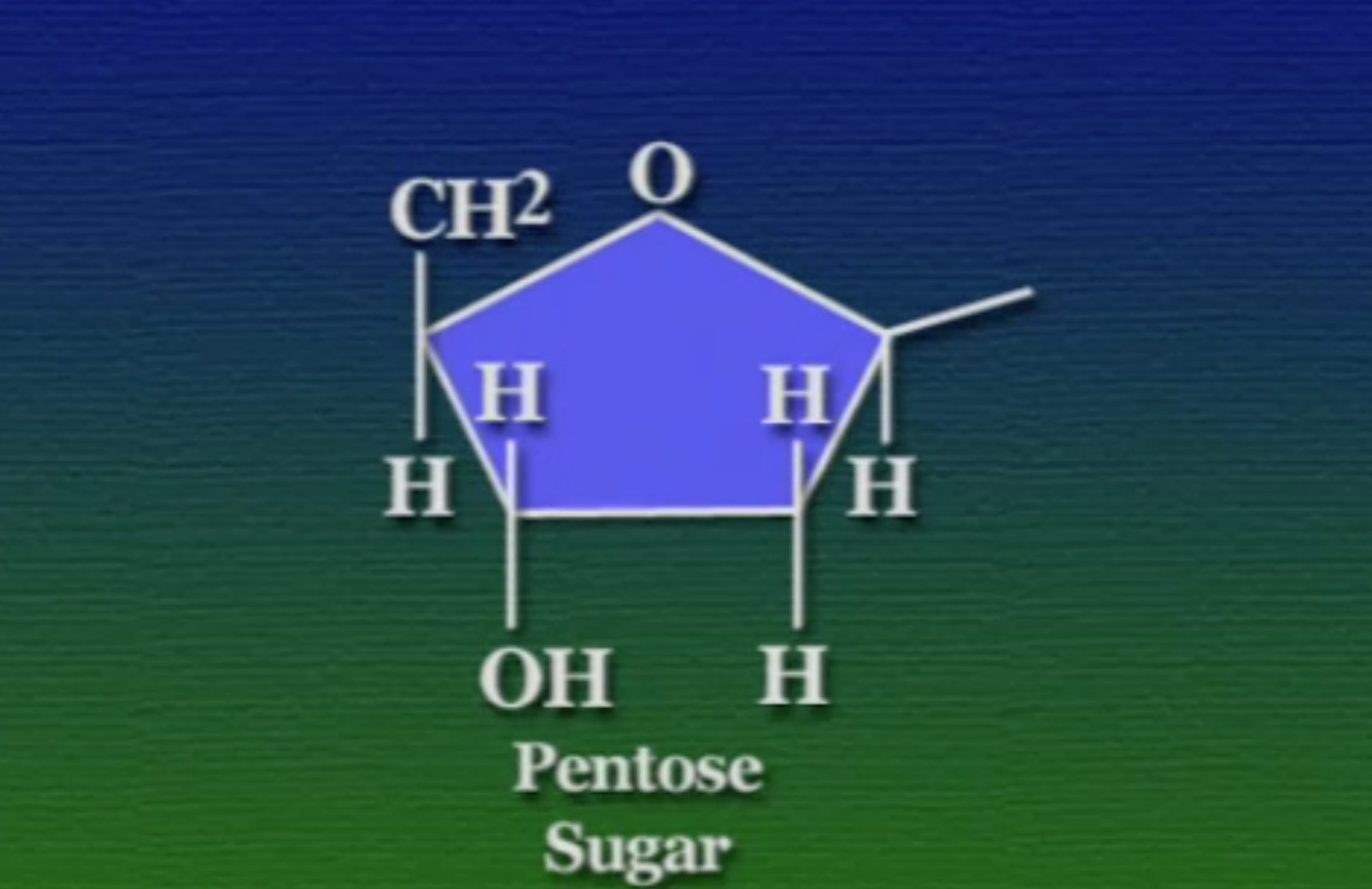
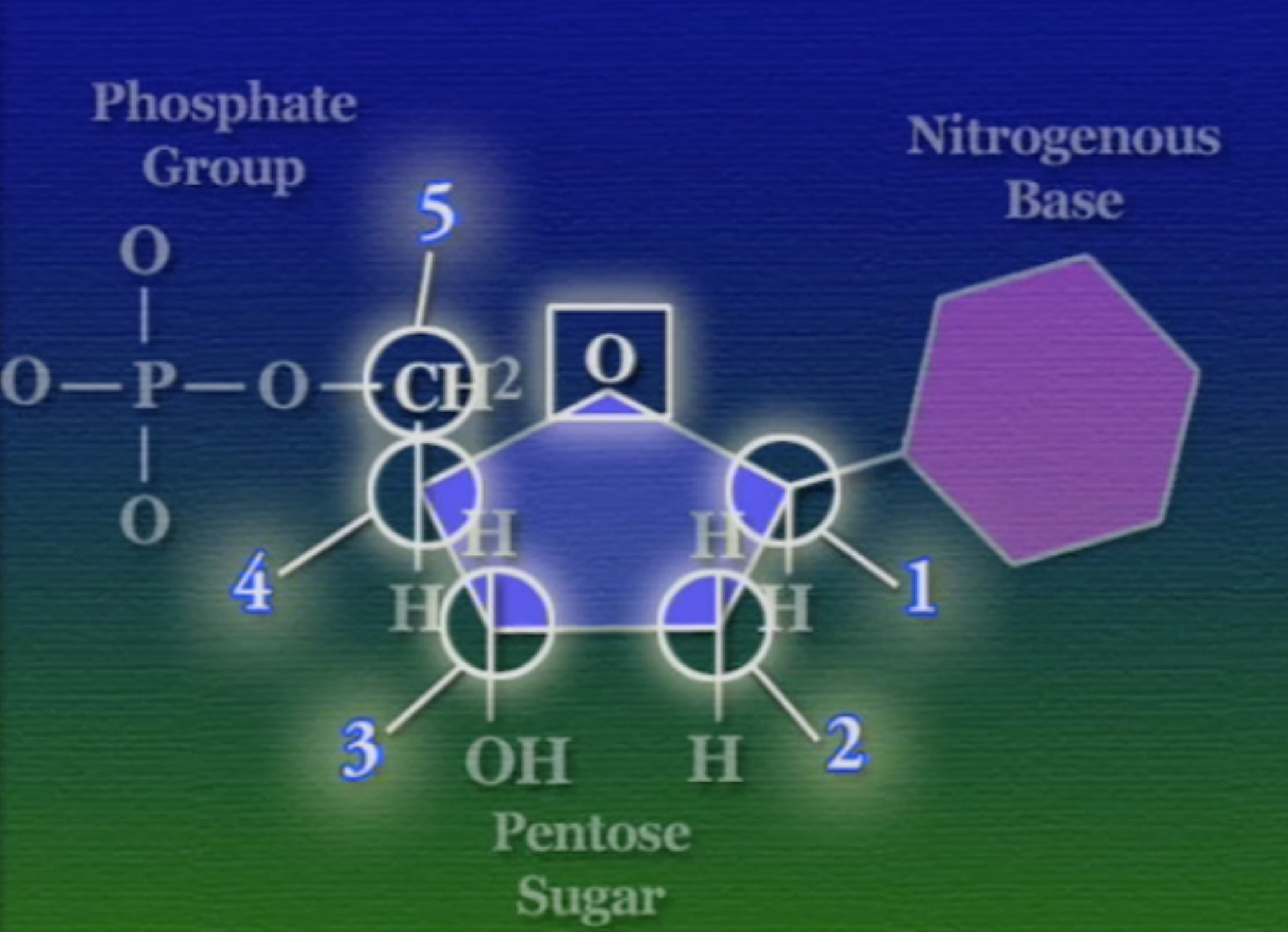
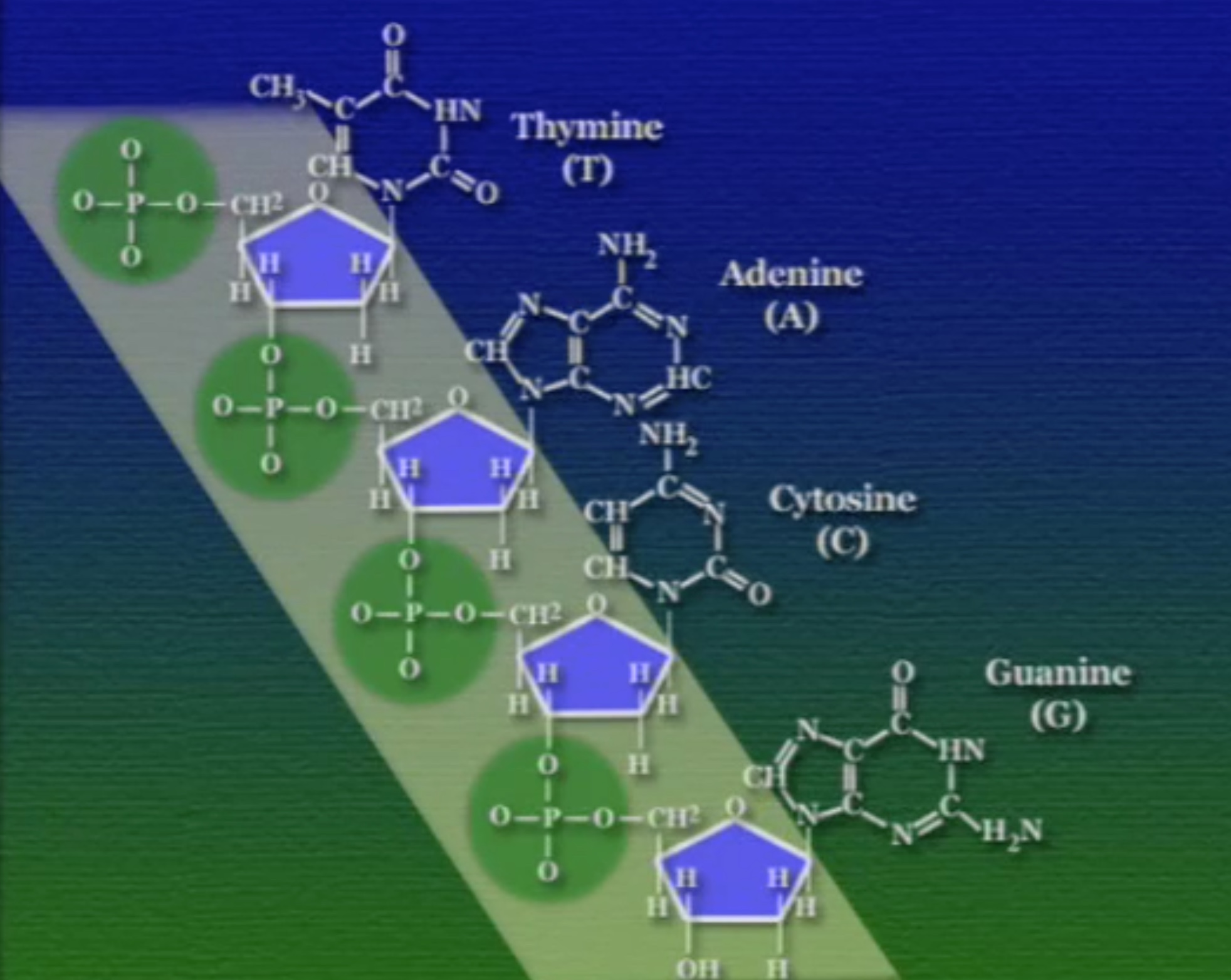
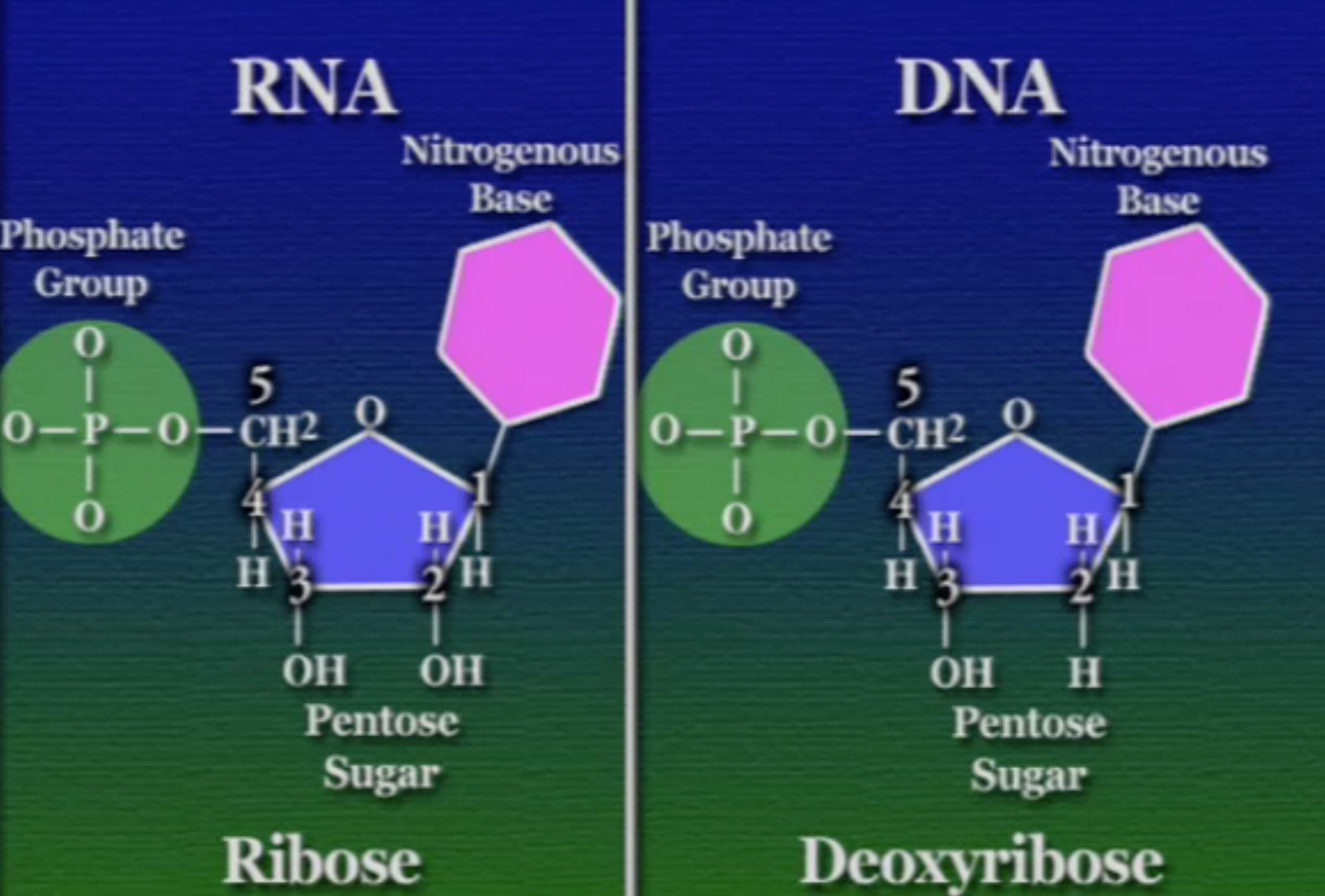
এই নিউক্লিইক-অ্যাসিড ভিত্তিক পলিমার দুই ধরণের হতে পারে। DNA ও RNA। প্রথমে আসা যাক এই DNA-এর গঠনে। DNA একটা পলিমার, এটা নিউক্লিইক-অ্যাসিড নামক মনোমার দিয়ে তৈরি। প্রকৃতিতে চার ধরণের নিউক্লিইক-অ্যাসিড পাওয়া যায়। এদের প্রত্যেকের গঠন মূলত একই। নিউক্লিইক-অ্যাসিডের মূল ভিত্তি একটা সুগার বা চিনি, একে বলে পেন্টোজ-সুগার কারণ, এর আকার পঞ্চভুজের মতো, যার পাঁচ কোণে একটা কার্বন পরমাণু থাকে।
এই পেন্টোজ-সুগারের এক কোণে লাগানো থাকে একটা ফসফেট-গ্রুপ। ফসফেট-গ্রুপ হলো ফসফরাস ও অক্সিজেন দিয়ে তৈরি একটি যৌগ।
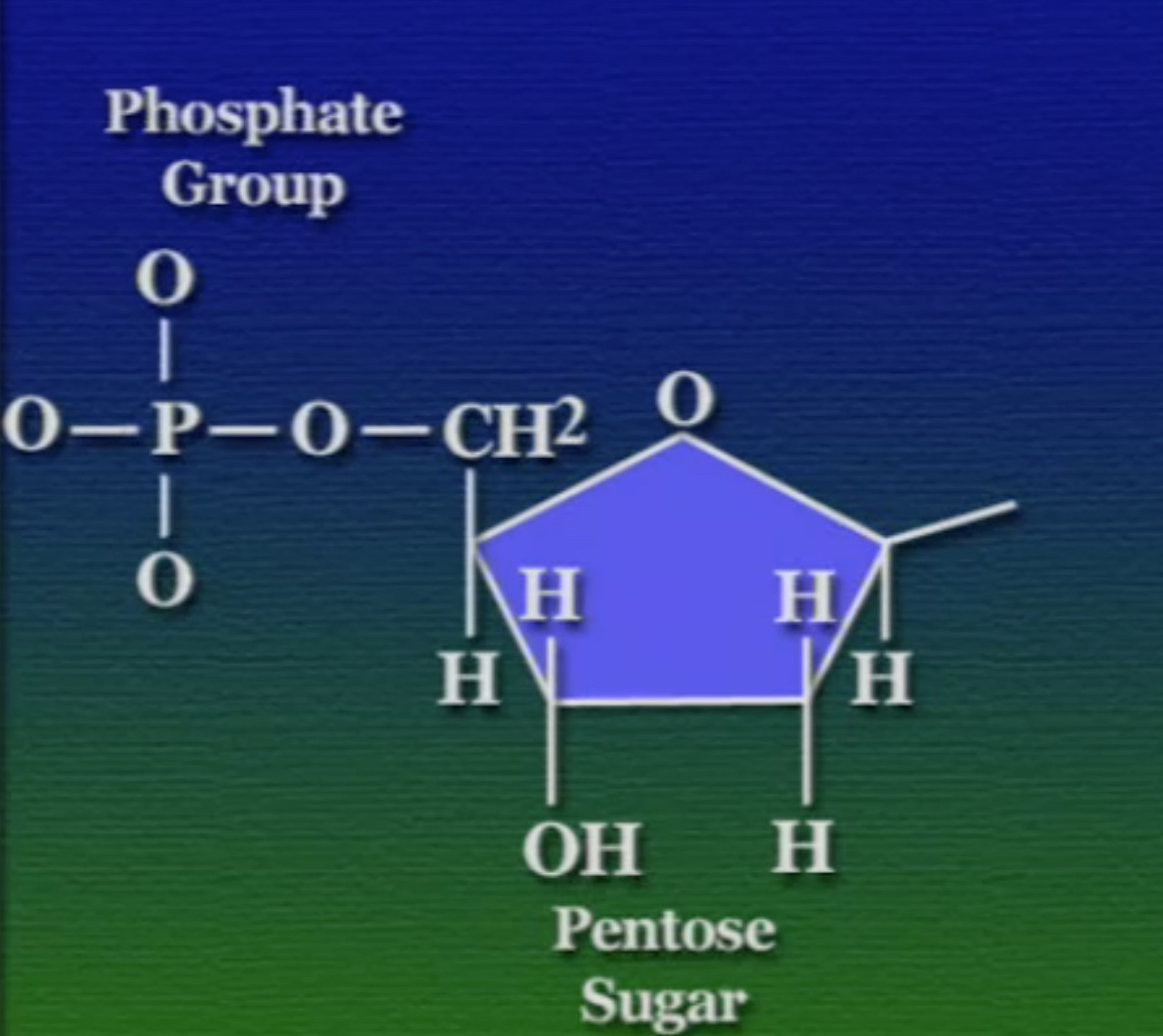
অন্যান্য কোণগুলোতে থাকে একটা নিঃসঙ্গ অক্সিজেন(O), একটা নিঃসঙ্গ হাইড্রোজেন(H), একটা হাইড্রক্সিল-গ্রুপ(OH), এবং একটা নাইট্রোজেনাস-বেস (Nitrogenous Base)। বিভিন্ন নিউক্লিইক-অ্যাসিডের ক্ষেত্রে এই নাইট্রোজেনাস-বেসটি ভিন্ন ভিন্ন হয়। এই নাইট্রোজেনাস-বেসদের অনেক নামে ডাকা হয়, কখনো বলা হয় নিউক্লিয়টাইড (Nucleotide) আবার কখনোবা DNA-বেস (DNA bases)। নাইট্রোজেনাস-বেস দুই রকমের পাইরিমিডিন (Pyrimidine) ও পিউরিন (Purine)।
একটা ব্যাপার, পেন্টোজ-সুগারের পাঁচ কোণের প্রতিটি কার্বনের আলাদা আলাদা ক্রমিক সংখ্যা আছে। গুরুত্বপূর্ণ কার্বনগুলো হলো ৩ ও ৫ নম্বর। নিচের ছবিতে বোঝা যাচ্ছে, প্রথম কার্বনে থাকে নাইট্রোজেনাস-বেস, তিনে হাইড্রক্সিল-গ্রুপ, ও পাঁচে ফসফেট-গ্রুপ।
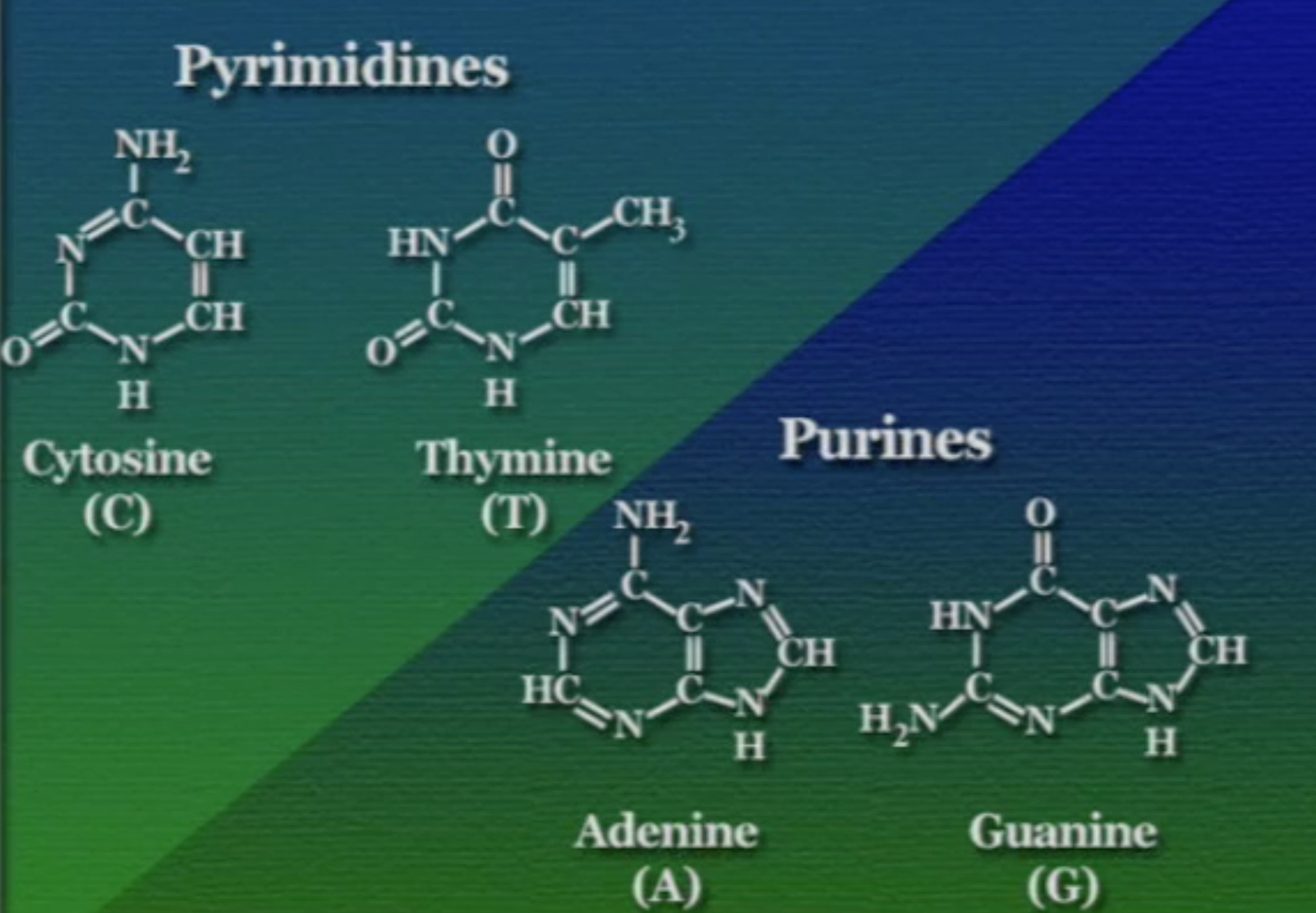
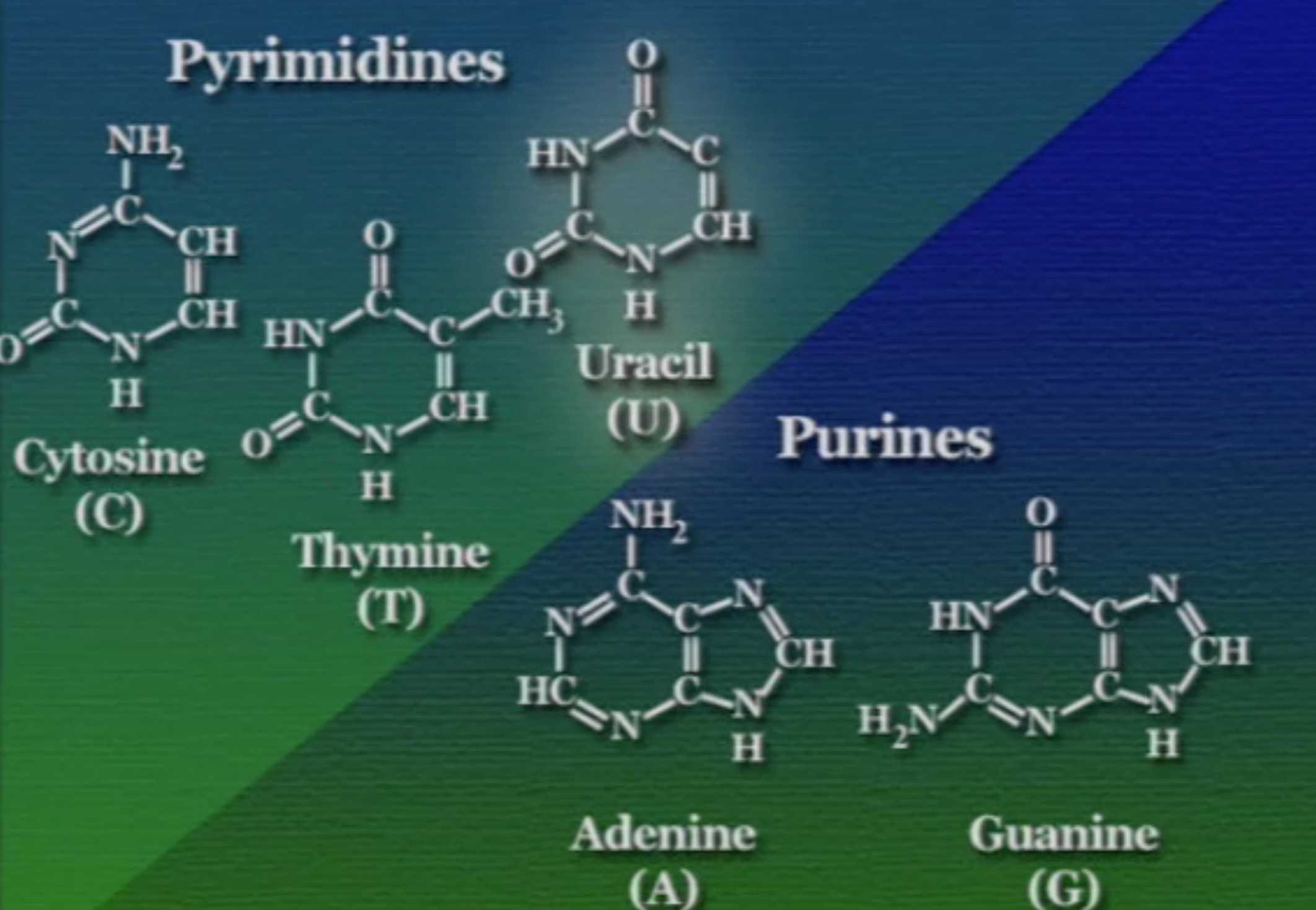
সাইটোসিন (C), ও থায়মিন (T) এই দুটি পাইরিমিডিন বেস। এদের নাইট্রোজেনাস-বেসে শুধু একটা চক্র (Ring) আছে তাই এরা অপেক্ষাকৃত ছোট। অন্যদিকে, এডেনিন (A) ও গুয়ানিন (G) এই দুটি পিউরিন। এদের নাইট্রোজেনাস-বেসে দুটি চক্র আছে তাই এরা অপেক্ষাকৃত বড়।
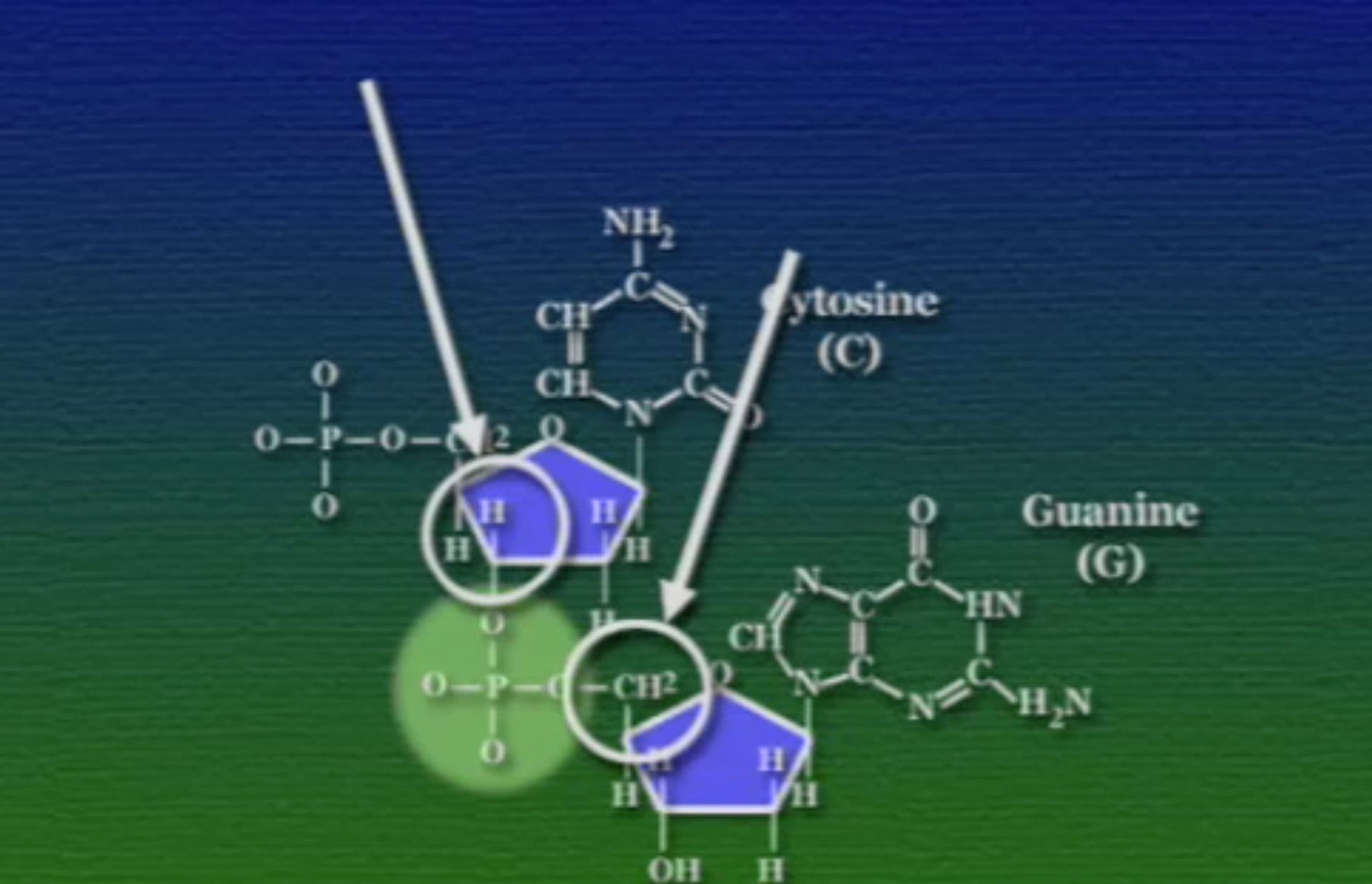
একাধিক নিউক্লিইক-অ্যাসিড যখন জোড়া লাগে তখন প্রথম নিউক্লিইক-অ্যাসিড তার ৫-নম্বর কার্বনের সাথে দ্বিতীয় নিউক্লিইক-অ্যাসিডের ৩-নম্বর কার্বনের সাথে একটা ফসফেট-গ্রুপের মাধ্যমে যুক্ত হয়। পেন্টোজ-সুগার ও ফসফেট-গ্রুপের এই বন্ধন শক্তিশালী কোভেলেন্ট ধরণের।
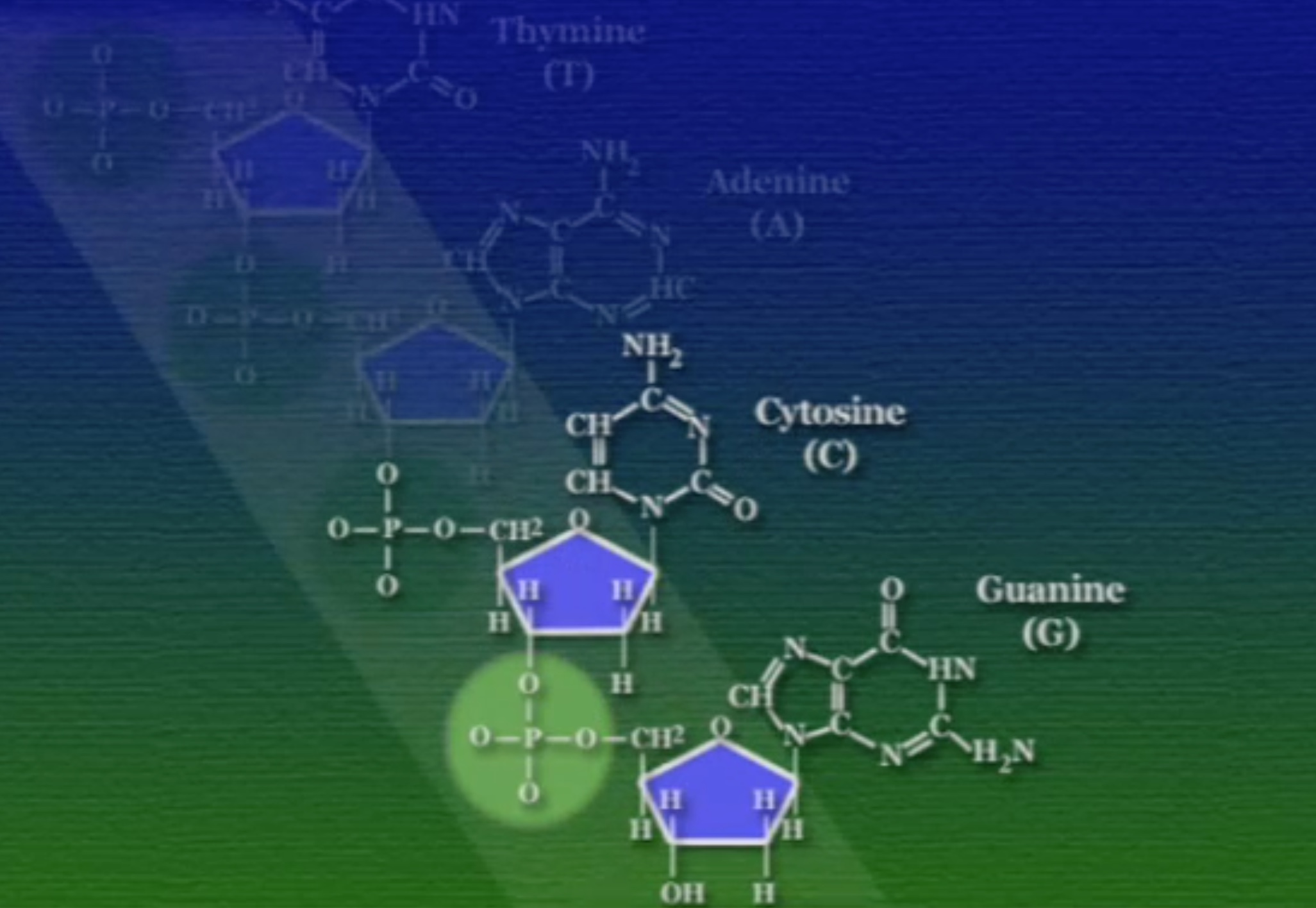
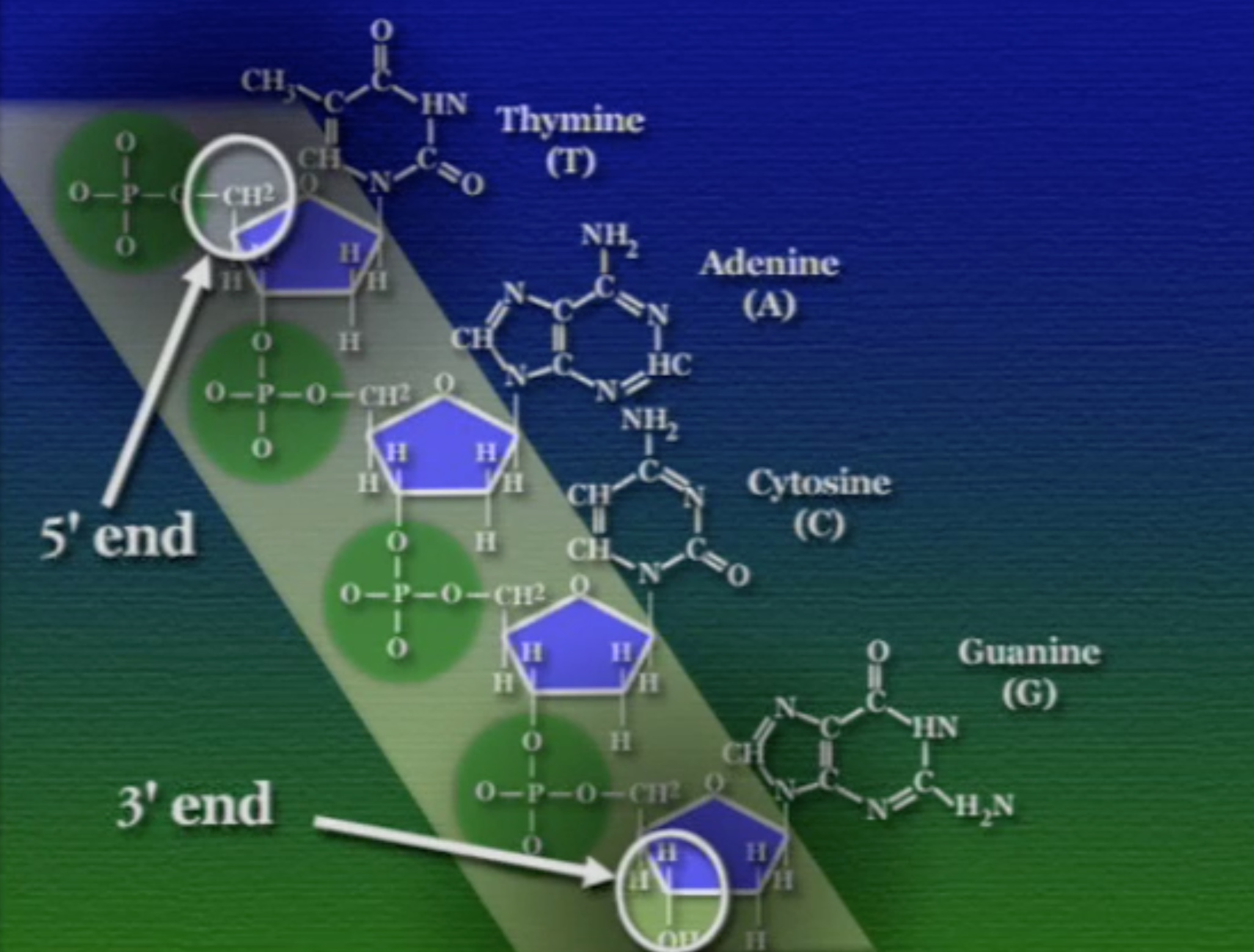
অনেকগুলো নিউক্লিইক-অ্যাসিড এভাবে জোড়া লেগে সুগার-ফসফেট ব্যাকবোন তৈরি করে। লক্ষ্য করার বিষয় হলো, এই সুগার-ফসফেট ব্যাকবোনের এক মাথায় একটা খোলা পঞ্চম-কার্বন প্রান্ত (5′ উচ্চারণ ফাইভ-প্রাইম ) আর অন্য মাথায় একটা খোলা তৃতীয়-কার্বন প্রান্ত (3′ উচ্চারণ থ্রি-প্রাইম) থাকে। এই প্রান্তগুলো DNA-এর মেরু নির্দেশ করে। এর আগে আমরা প্রোটিনের মেরুর কথা বলেছিলাম। DNA-এর এই মেরুকরণ প্রোটিনের মেরুর জন্য দায়ী।
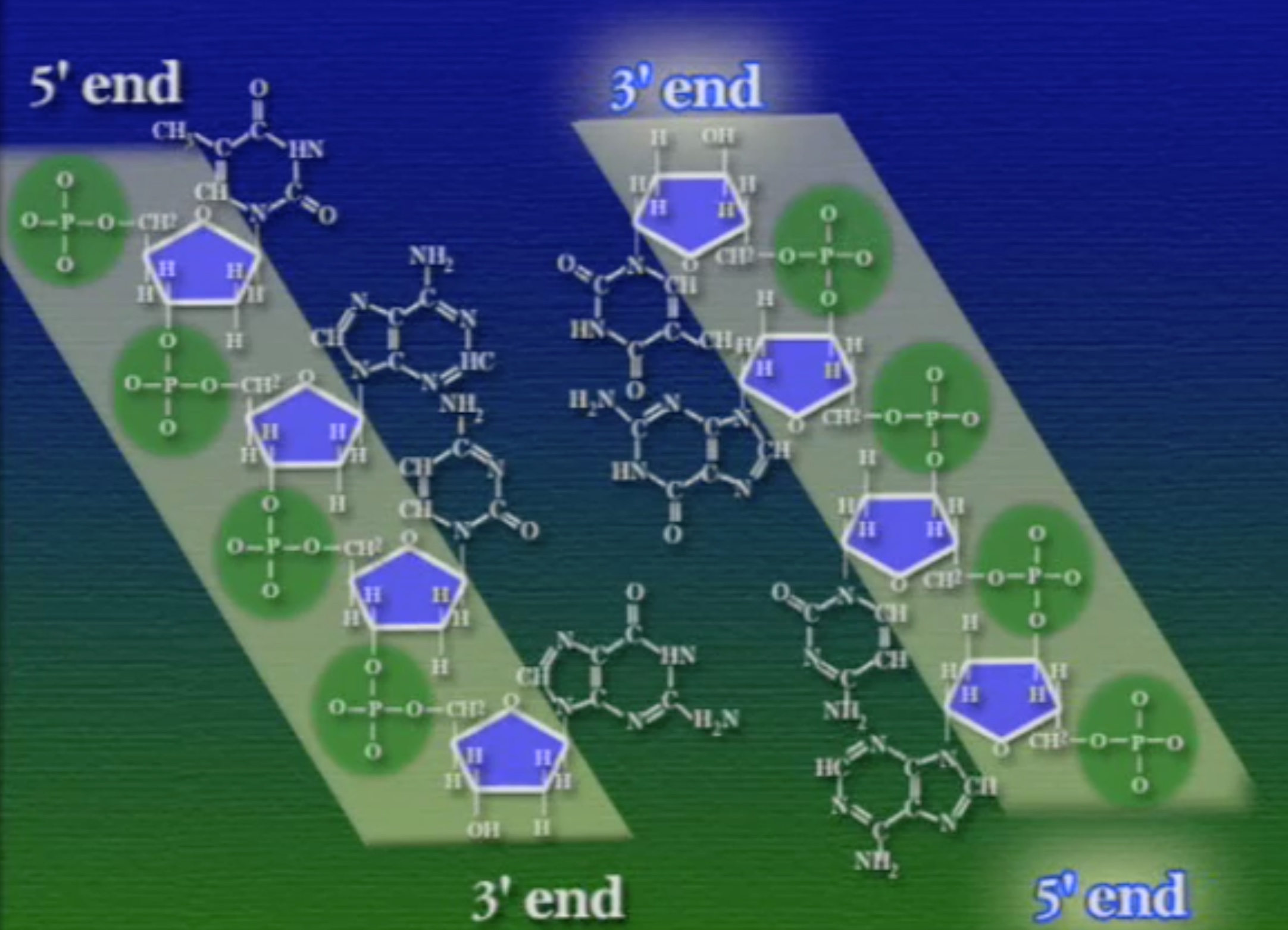
আমরা আগেই দেখেছি, প্রোটিনের আকার নির্ভর করে তার কাজের ওপর। অন্যদিকে, DNA হলো বংশগতির ধারক, একে দুটি কাজ করতে হয়, বংশগতি তথ্য ধারণ করা এবং নিজের প্রতিলিপি তৈরি করা বা রেপ্লিকেশন। জেমস ওয়াটসন ও ফ্রান্সিস ক্রিকের কল্যাণে DNA-এর ডাবল-হেলিক্স (Double Helix) কাঠামোর কথা আমরা জানি। ডাবল-হেলিক্স কাঠামোতে দুটো সুগার-ফসফেট ব্যাকবোন থাকে, তবে তাদের মেরু হয় উল্টো, অর্থাৎ, তাদের ৩-প্রান্ত এবং ৫-প্রান্ত একে ওপরের উল্টো দিকে।
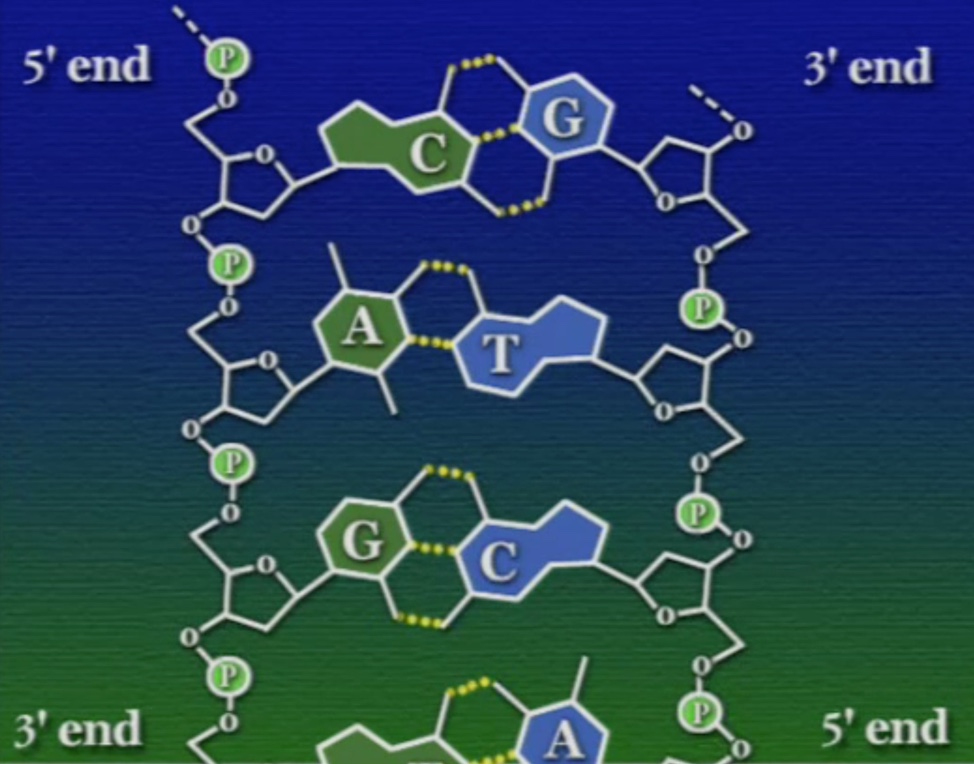
এই বিপরীত মেরুযুক্ত সুগার-ফসফেট ব্যাকবোন দুটি জোড়া লেগে থাকে নাইট্রোজেনাস-বেসগুলোর মধ্যকার দুর্বল হাইড্রোজেন বন্ধনের কারণে। আগে বলা হয়েছিলো, পাইরিমিডিনেরা আকারে ছোট আর পিউরিনেরা বড়। ওয়াটসন ও ক্রিক লক্ষ্য করেছিলেন যে, ডাবল হেলিক্স কাঠামোর প্রস্থ আগাগোড়াই সমান, প্রায় ২ ন্যানোমিটার। এ থেকেই বোঝা যায় যে, পাইরিমিডিন ও পিউরিন নিজেদের মধ্যে নয় বরং পরস্পরের সাথে হাইড্রোজেন বন্ধন তৈরি করে। স্পস্ট করে বললে, এডেনিন (A) থায়মিনের (T) সাথে আর সাইটোসিন (C) ও গুয়ানিনের (G) সাথে হাইড্রোজেন বন্ধন তৈরি করে। তাই এদের কমপ্লিমেন্টারি-বেস-পেয়ার বলে (Complementary Base Pair)। আপনি যদি, ডাবল-হেলিক্সের সুগার-ফসফেট ব্যাকবোন দুটিকে ধরে দুই দিকে টান দেন তবে, এই হাইড্রোজেন বন্ধন ভেঙ্গে যাবে আর কমপ্লিমেন্টারি-বেসগুলো জ্যাকেটের জিপারের মতো খুলে আসবে।
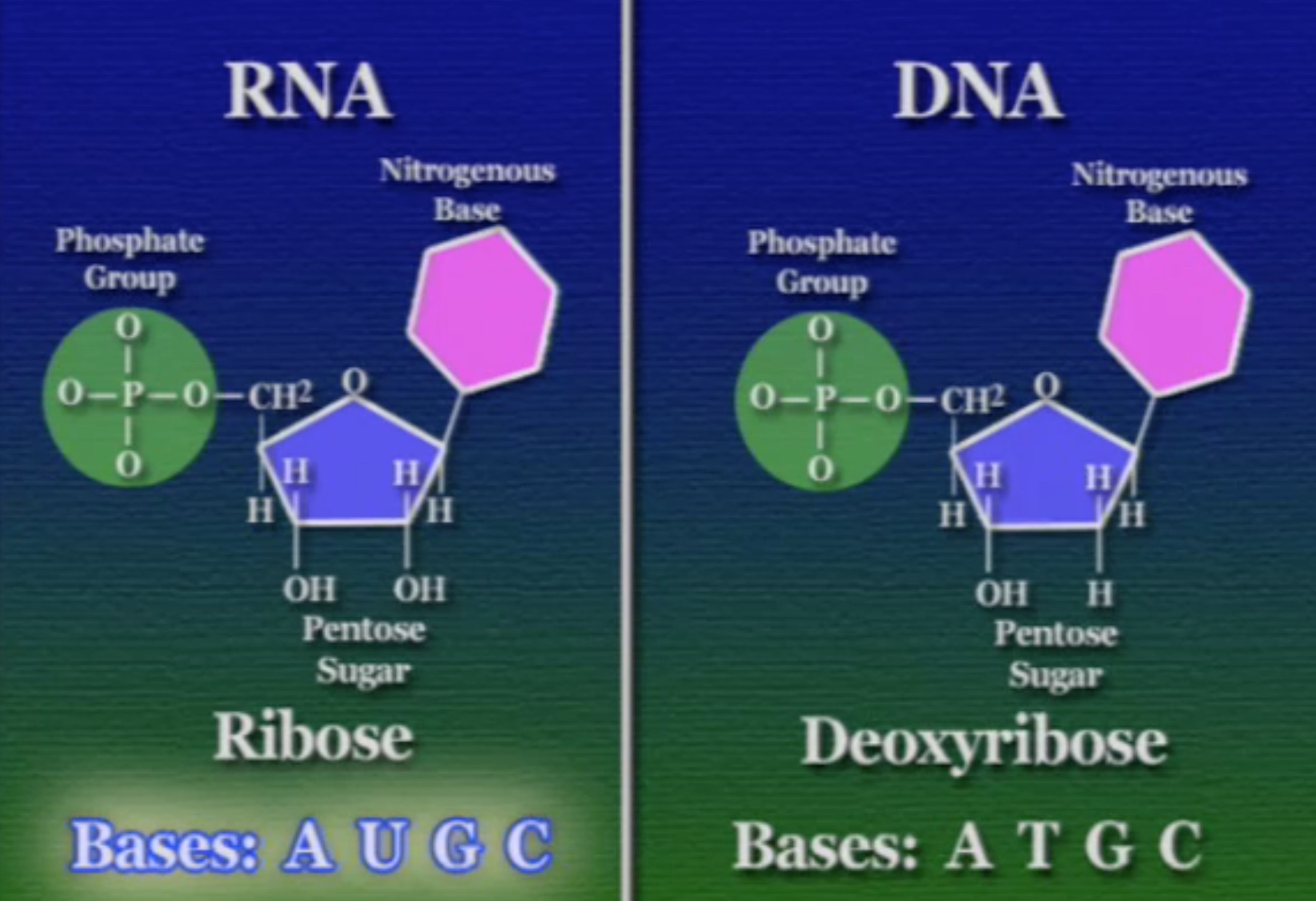
DNA ও RNA মধ্যকার পার্থক্য তিনিটি। প্রথম দুটি এখানে আলোচনা করা হলো। DNA-এর সুগার-ফসফেট ব্যাকবোনের পেন্টোজ-সুগারটির দ্বিতীয় কার্বনে একটা নিঃসঙ্গ হাইড্রোজেন যুক্ত থাকে। অন্যদিকে, RNA-এর ঠিক ঐ কার্বনে একটা হাইড্রক্সিল-গ্রুপ যুক্ত থাকে। RNA-এর হাইড্রক্সিল-গ্রুপ যুক্ত পেন্টোজ-সুগারটির ভালো নাম রাইবোজ সুগার। এই রাইবোজ সুগারটি যখন তার হাইড্রক্সিল-গ্রুপ থেকে অক্সিজেন হারায় তখন তাকে বলে ডিঅক্সি-রাইবোজ সুগার। মূলত, পেন্টোজ-সুগারের হাইড্রক্সিল-গ্রুপ থাকা না থাকা নিয়ে RNA ও DNA-এর নামকরণ করা হয়েছে। RNA হলো রাইবো-নিউক্লিইক-অ্যাসিড, আর DNA ডিঅক্সিরাইবো-নিউক্লিইক-অ্যাসিড।
দ্বিতীয় পার্থক্য হলো, কোনো এক অজ্ঞাত কারণে RNA নাইট্রোজেনাস-বেস থায়মিনের পরিবর্তে ইউরেসিল (U) ব্যবহার করে। থায়মিন এবং ইউরেসিল ভিন্ন যৌগ হলেও তারা কাঠামোগতভাবে এক।
সুতরাং, DNA ও RNA দুইয়ের মধ্য পার্থক্য হলো এরকম।
RNA-এর কাঠামো এখানে আলোচনা করা হলো না। এর কারণটা হলো, বিভিন্ন RNA-এর কাঠামো নির্ভর করে মূলত প্রোটিন সংশ্লেষণে তার ভূমিকার ওপর। আর শুধু সেজন্যই পুরো আলাদা আলোচনা দরকার।
আমরা জানি, DNA প্রোটিন সংশ্লেষণের (Synthesis) নক্সা হিসেবে কাজ করে এবং প্রকৃতিতে নিউক্লিইক-অ্যাসিড চারটি কিন্তু, অ্যামিনো-অ্যাসিড বিশটি। তাহলে, কিভাবে চারটি নিউক্লিইক-অ্যাসিড বিশটি অ্যামিনো-অ্যাসিডকে নির্দিষ্ট করে? মলিকুলার বায়োলজির কল্যাণে আমরা আজ জানি, প্রতি অ্যামিনো-অ্যাসিডকে সূচিত করতে দরকার তিনটি নিউক্লিইক-অ্যাসিড। একে বলে ট্রিপলেট কোডিইং। আর একেকটি ট্রিপলেট কোডকে বলে কোডোন (Codon)।
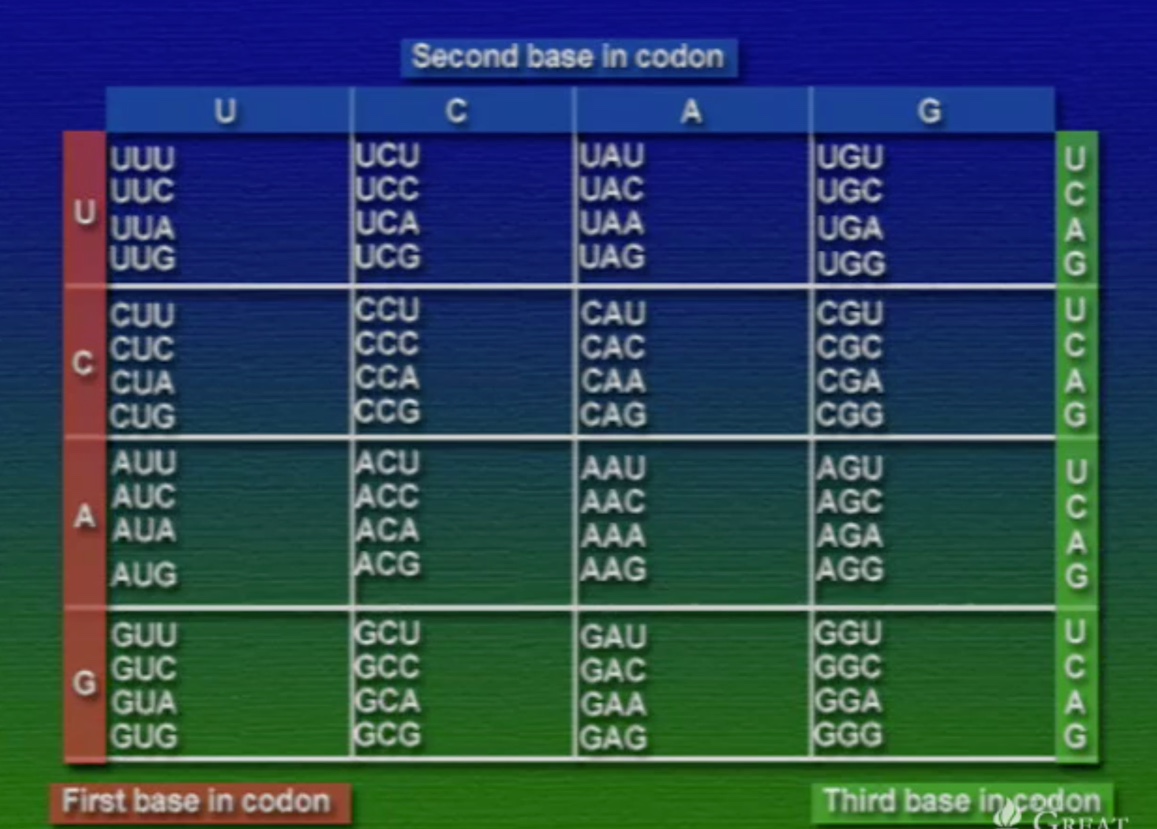
যদি চারটি নিউক্লিইক-অ্যাসিডকে ট্রিপলেট বিন্যাসে সাজানো হয় তবে ৪x৪x৪=৬৪ টি কোডোন পাওয়া যাবে। এই ৬৪টি কোডোন ওপরের টেবিলে দেখানো হয়েছে। এবার দেখা যাক, এই কোডোনগুলো কে কোন অ্যামিনো-অ্যাসিডকে সূচিত করে।

কোডোন ডিকশেনারীর কয়েকটা গুরুত্বপূর্ণ বৈশিষ্ট্য হলো, একটা অ্যামিনো-অ্যাসিডকে একাধিক কোডোনের মাধ্যমে নির্দেশ করা যায়। যেমন: সেরিনকে চারটি কোডোন দিয়ে সূচিত করা যায়। অন্যদিকে, একটা কোডোন শুধু একটা অ্যামিনো-অ্যাসিডকেই নির্দেশ করে। যেমন: UAU শুধুই থাইরোসিনকে বোঝায়। তাই কোডোন ও অ্যামিনো-অ্যাসিড সম্পর্কে কোনো অস্পষ্টতা নেই। ৬৪টি কোডোন মধ্যে ৬১টি অ্যামিনো-অ্যাসিড নির্দেশ করে বাকি তিনটি স্টপ-কোডোন। প্রোটিন সংশ্লেষণের সময় এই স্টপ-কোডোনগুলো পলিপেপটাইড-চেইনের সমাপ্তি নির্দেশ করে, ফলে, সংশ্লেষণের প্রক্রিয়া বন্ধ হয়ে যায়। অন্যদিকে, সংশ্লেষণ প্রক্রিয়া শুরু হয় AUG কোডোন দিয়ে। মজার ব্যাপার হলো, AUG একমাত্র স্টার্ট-কোডোন কিন্তু, এটা মিথাইয়ােনিন নির্দেশ করে। এর মানে হলো, প্রোটিন সংশ্লেষণে প্রতিটি পেপটাইড চেইন শুরু হয় মিথাইয়ােনিন দিয়ে। কিন্তু, পেপটাইড চেইনকে যখন ভাঁজ করে চূড়ান্ত প্রোটিনের আকার দেওয়া হয়, ঠিক তখনই দরকার না হলে এই মিথাইয়ােনিনকে ছেঁটে বাদ দেয়া হয়।
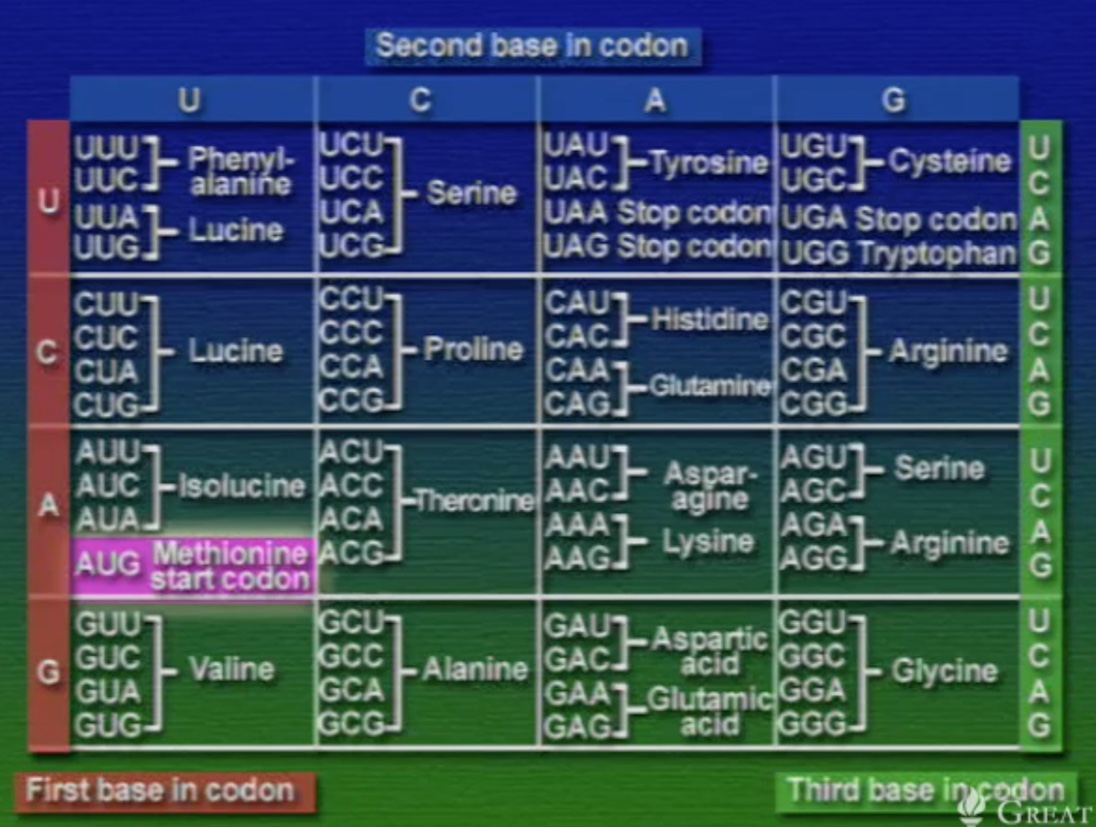
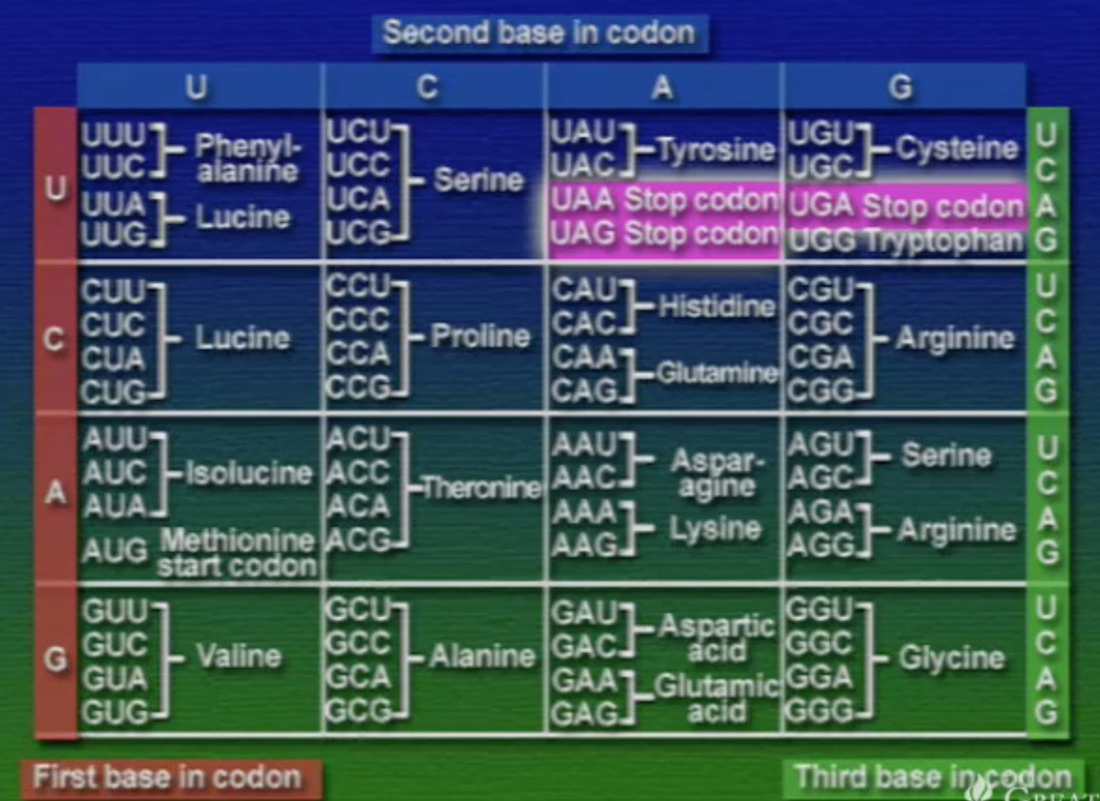
এই কোডোন ডিকশেনারী মানব ইতিহাসের একটা অত্যন্ত গুরুত্বপূর্ণ আবিষ্কার। প্রতিটি জীবন এই কোডোন অনুসরণ করে। শুধু এই কোডোনই নয়, এই কোডোন থেকে প্রোটিন সংশ্লেষণ প্রাণীজগতের সবার জন্য সমান।
অবলম্বনে: “The Great Courses” থেকে প্রকাশিত “Biology: The Science of Life” by “Stephen Nowicki”